研究人员通过对小鼠进行研究后发现,阻断包括Brd4和IL-1β的巨噬细胞纤维化通路中的不同步骤或能帮助减缓患心脏病动物机体的心脏纤维化发生。
如果你割伤了手臂或做了手术,留下疤痕或许是件好事,由成纤维细胞所产生的疤痕组织能帮助机体愈合,然而,在大多数机体器官中,疤痕的积累(称为成纤维化)是慢行疾病和衰老发生的标志,减缓或阻断纤维化能帮助治疗心脏病、肝病、肾脏疾病和肺部疾病等,然而,这些器官的纤维化依然是一种致死性疾病,目前治疗手段非常有限。
近日,一篇发表在国际杂志Nature上题为“Chromatin remodelling drives immune cell–fibroblast communication in heart failure”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究清楚揭示了免疫细胞如何诱发形成疤痕的成纤维细胞被激活从而导致心脏或其它器官发生纤维化的,阻断引起炎症的免疫细胞和成纤维细胞之间的分子信号或会预防纤维化的发生,然而,偶然的是,一些信号已经能被当前的药物靶向作用,而这些药物也能潜在被重新定向用于治疗人类心脏病。
研究者Michael Alexanian博士说道,免疫系统和成纤维细胞之间的串扰(crosstalk)要比我们预期的要复杂得多,如今我们开始绘制其串扰的图谱,这样或许能开发出新型疗法来靶向作用炎症和纤维化。炎症和纤维化在恶化机体心力衰竭和很多其它纤维化疾病方面扮演着非常重要的角色,心力衰竭在全球影响着2500万人的健康;发现阻断这些疾病过程的新方法或能帮助改善数百万人的健康。
科学家们早就知道,炎症和纤维化会在病变器官和正常衰老过程中同时发生,心脏、肝脏、肾脏和肺脏的纤维化会导致器官不健康的变厚和硬化,从而妨碍其正常功能的发挥并引起器官衰竭;然而炎症所发挥的确切作用,以及其是如何直接引起纤维化的,目前研究人员并不是非常清楚。这项最新研究中,研究人员利用小鼠来追踪除了成纤维细胞外,免疫细胞是如何在心脏病中发生改变,随后他们利用名为BET抑制剂的药物来处理小鼠,此前研究人员发现这种药物能预防动物机体的纤维化,但却对其它组织会产生很多副作用,研究人员旨在解析心脏病被治疗时细胞会发生什么变化,并利用相关研究结果开发适用于人类的更多靶向性疗法。
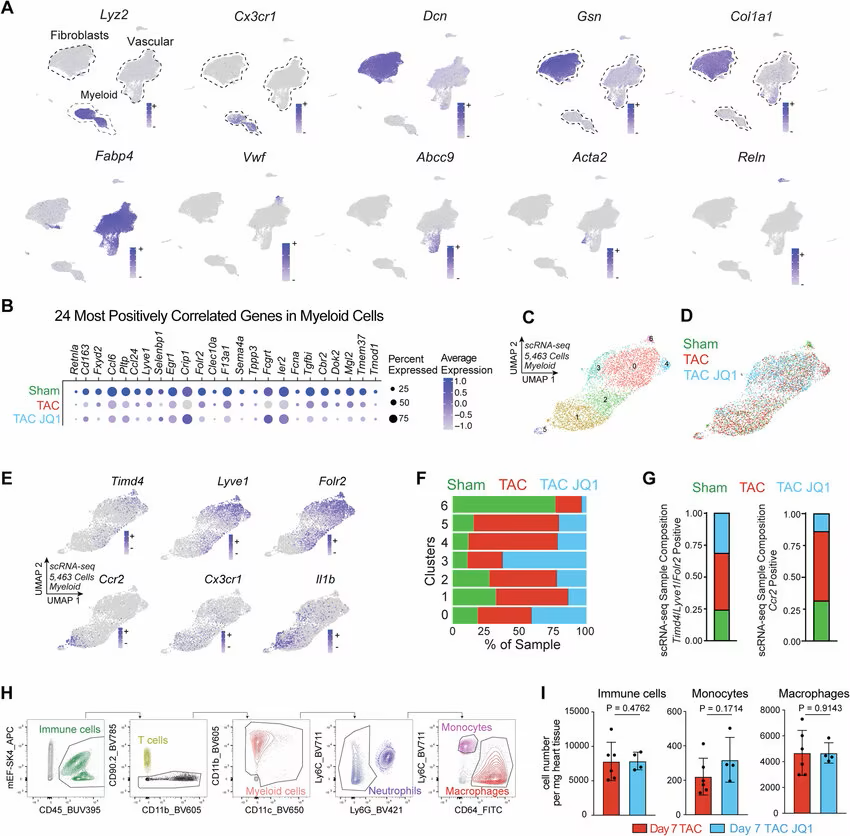
利用BET抑制,对心衰患者进行单细胞RNA测序或能鉴定出高动态表达cx3cr1的单核/巨噬细胞亚群
研究者表示,在心力衰竭发生期间,免疫细胞中会有很多促炎性基因被激活,随后在治疗过程中被抑制,因此,很显然,利用这种药物就能关闭机体炎症和纤维化。随后,通过对免疫细胞和成纤维细胞进行一系列实验,研究人员发现炎症和纤维化之间存在着新型分子关联,他们详细描述了从巨噬细胞开始的一系列事件,巨噬细胞是一种在诱发炎症方面扮演着中枢性角色的关键免疫细胞。早在2021年,研究人员发现,在成纤维细胞中,开启名为MEOX1的基因就能通过激活细胞来诱发纤维化发生,然而,他们并不知道成纤维细胞是如何感知心脏中的压力从而被激活的。
这项研究中,研究人员发现,当心脏处于疾病状态时,调节性基因Brd4就会在巨噬细胞中被开启,从而就会促使免疫细胞产生信号分子IL-1β,当其与邻近成纤维细胞发生相互作用时,IL-1β蛋白就会激活成纤维细胞中的“主开关”MEOX1,如今研究人员已经将其与纤维化过程联系了起来。研究者Padmanabhan说道,我们能够准确阐明巨噬细胞中炎性发生的位置以及其是如何影响纤维化过程的,理解整个事件链或能帮助我们从多个角度更早地干预这一过程并寻找更好地方法来预防患者机体纤维化的发生。实际上,研究人员通过对小鼠进行研究后发现,阻断包括Brd4和IL-1β的巨噬细胞纤维化通路中的不同步骤或能帮助减缓患心脏病动物机体的心脏纤维化发生。
此外,由于IL-1β在驱动全身炎症发生中还扮演着其它角色,如今研究人员已经开发出了能阻断多种疾病中IL-1β活性的药物,包括癌症、类风湿性关节炎和糖尿病等,但要确定是否这些药物会影响心脏或其它器官中的纤维化,或许还需要后期研究人员进行其它的研究。最后研究者表示,如今我们知道了所参与的信号通路,这或许就能帮助我们开发出靶向性药物来阻断纤维化发生,同时还能阻断免疫系统的积极性效应,比如抵御感染等。
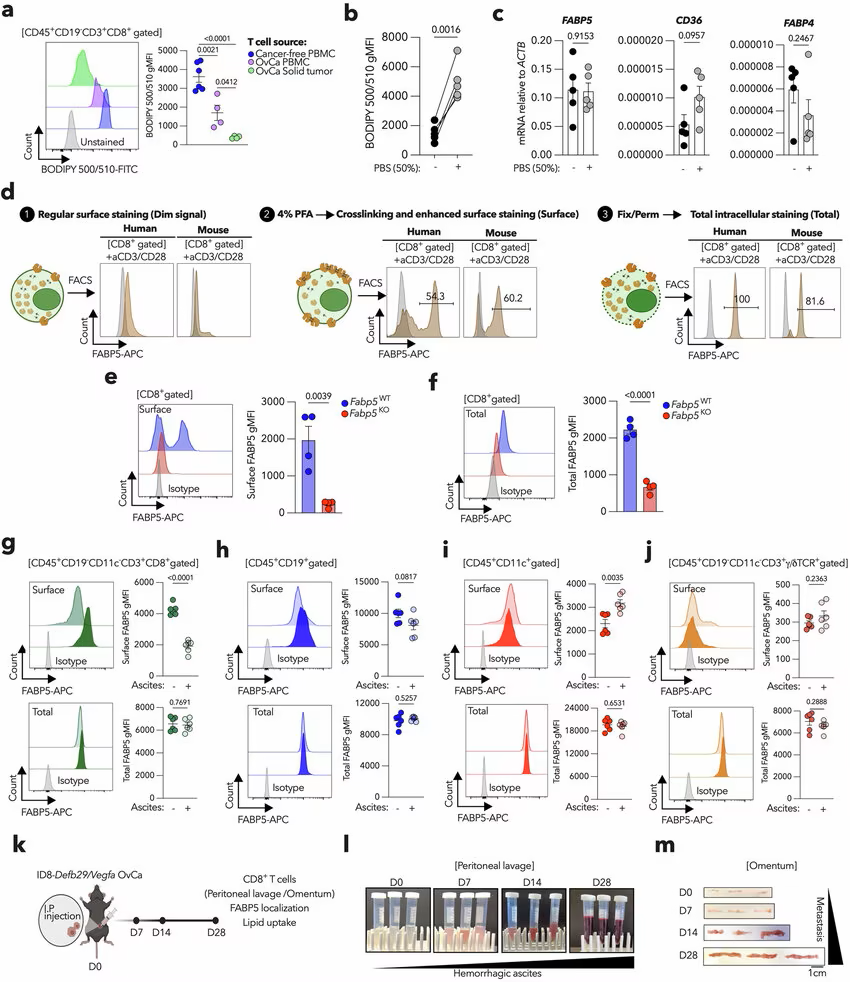
对T细胞中FABP5的表达进行分析
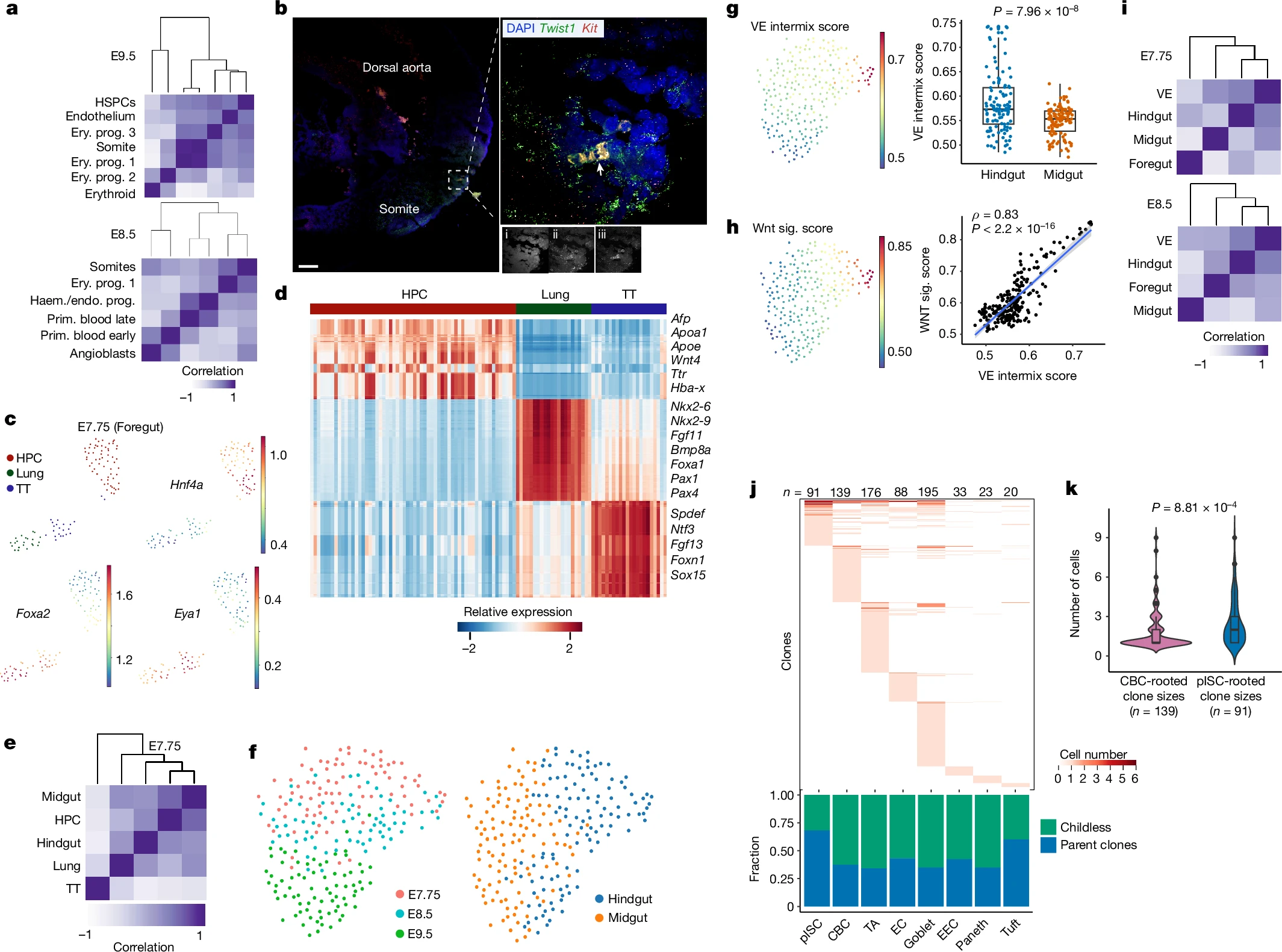
研究者Ken Lau说道,我们希望增加一个时间轴能帮助更好地理解组织发育和疾病达到起源。尽管只有极低比例的癌前病变会进展到癌症,但目前唯一能预测结直肠癌的指标就是结肠息肉的尺寸,即会发生癌变的结肠细胞小团块,如今研究人员已经开发出了一种精确的分子时钟来在单细胞分辨率下记录细胞事件的时间。
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




