转录活性的模式是通过诸如启动子或增强子等调控元件编码在我们的基因组中的,然而矛盾的是,其包含了类似序列特异性转录因子(TF)结合位点的分类,理解这些序列基序如何编码多个(通常是重叠的)基因表达程序对于理解基因调节以及非编码DNA突变如何在疾病中的表现是至关重要的。
近日,一篇发表在国际杂志Nature上题为“Position-dependent function of human sequence-specific transcription factors”的研究报告中,来自华盛顿州立大学等机构的科学家们通过研究表示,一种在DNA中新发现的特殊代码(被称为“空间语法”,spatial grammar)或许是理解基因活性是如何人类基因组中被编码的关键。
这一研究性突破揭示了长期以来被认为隐藏在DNA中的“空间语法”,或有望重塑科学家们对基因调节机制的理解以及阐明在机体发育或疾病发生过程中基因突变影响基因表达背后的分子机制。转录因子是控制基因组中基因开启或关闭的特殊蛋白,其在这些代码功能发挥中扮演着至关重要的角色,长期以来,科学家们认为转录因子是基因活性的激活子或抑制子,但本文研究结果表明,转录因子的功能或许要复杂得多。
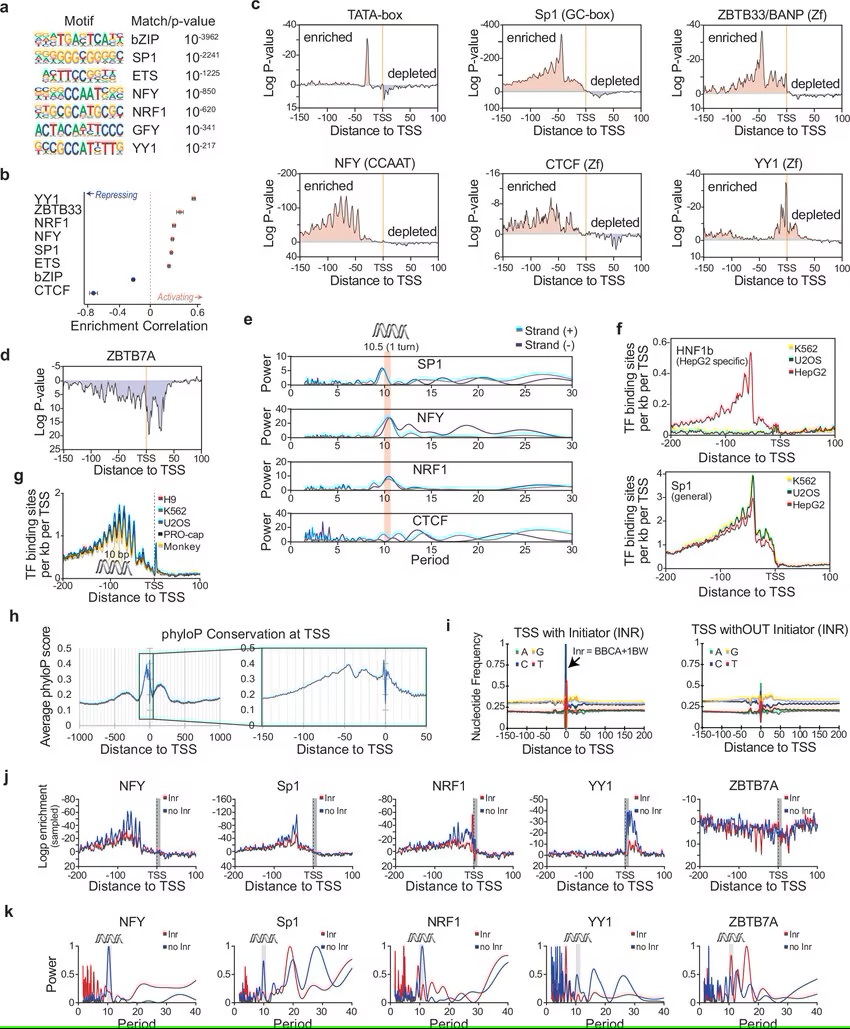
研究者Sascha Duttke教授说道,与我们在教科书上看到的相反,扮演真正激活子或抑制子的转录因子实际上非常罕见,相反,我们发现,大多数的激活子也能作为抑制子发挥功能。如果你移除了一个激活子,你的假设是你失去了激活的功能,但只有50%至60%的案例是这种情况,所以我们意识到有些事情或许是不对劲的。通过仔细观察后,研究人员发现很多转录因子的功能或许高度依赖于其所处的位置。
研究者发现,转录因子之间的间隔和其相对于基因转录开始的位置或许决定了基因活性的水平,比如,当转录因子处于基因转录起始位点的上游或前方时,其就会激活基因的表达,而当其位于基因转录起始位点的下游或之后时,或许就会抑制基因的表达。Duttke博士说道,这是间隔或“环境”,其决定了一个既定的转录因子到底能扮演激活子还是抑制子的角色;与学习一门新语言类似,学习基因组中基因表达的模式是如何被编码的,研究人员还需要理解其单次和语法。
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




