甲状腺激素在调节人体的代谢、体温、心率以及生长等方面扮演着至关重要的角色。它通过与身体各个器官系统的互动来实现这些功能。尽管甲状腺激素对许多器官的影响已被广泛研究,但其对大脑的具体作用却一直未被完全理解。
如今,在一项新的研究中,来自哈佛医学院的研究人员通过小鼠实验揭示了甲状腺激素对大脑的新见解。研究表明,甲状腺激素可以改变大脑回路,促进探索行为的发生。通过改变大脑回路和代谢率,研究人员发现甲状腺激素能在关键时刻协调大脑和身体的功能,比如在小鼠需要寻找配偶或储备资源的时候。
相关研究结果于2024年8月22日在线发表在Cell期刊上,论文标题为“Thyroid hormone remodels cortex to coordinate body-wide metabolism and exploration”。

论文的第一作者,哈佛医学院布拉瓦特尼克研究所的神经生物学研究员Daniel Hochbaum博士指出,甲状腺激素不仅能调节代谢,还能通过直接影响大脑来调节探索行为。
这些发现有助于解释低水平的甲状腺激素为何会导致抑郁状态,表现为探索欲望降低;而高水平的甲状腺激素则可能导致躁狂状态,表现为过度活跃的探索欲望。因此,这项研究为理解甲状腺激素水平异常如何引发某些精神疾病提供了重要线索。
Hochbaum对甲状腺激素的兴趣源自个人经历:他的妻子因突然的行为和代谢变化被诊断为甲状腺功能亢进症。虽然治疗帮助她恢复了健康,但这段经历让Hochbaum产生了深入探究甲状腺激素如何影响大脑的想法。他说:“我发现甲状腺激素对精神状态有显著影响,这让我感到非常惊讶。”。Hochbaum了解到,甲状腺激素不足会减慢新陈代谢,导致抑郁症状;而过多的甲状腺激素则会加速新陈代谢,引发躁狂症状。但是,关于这种现象背后的科学机制,他未能找到满意的解释。在一个偶然的机会里,Hochbaum与哈佛医学院的神经生物学教授Bernardo Sabatini交流时,发现Sabatini也有相同的疑问。“甲状腺激素为何会影响行为,这个问题从我在医学院学习时就开始困扰我了,”Sabatini说道,“我们至今不清楚这种激素是如何进入大脑并产生作用的。”于是,一个旨在研究甲状腺激素在大脑中功能的项目就此启动。甲状腺激素在血液中循环,并能够进入几乎所有的细胞和组织。甲状腺、脑垂体和下丘脑之间的复杂互动控制着甲状腺激素的水平。然而,甲状腺激素的受体不仅限于下丘脑,而是广泛分布在大脑的各个部分,包括负责高级认知功能如规划和决策的大脑皮层区域。Hochbaum指出:“特别值得注意的是,在成人大脑中,甲状腺激素受体几乎是无所不在的。”
为了探究其原因,Hochbaum、Sabatini及其团队对小鼠的大脑皮层细胞进行了基因测序。研究发现,甲状腺激素通过激活多个基因影响大脑皮层中的神经回路,从而改变了神经元之间的连接方式。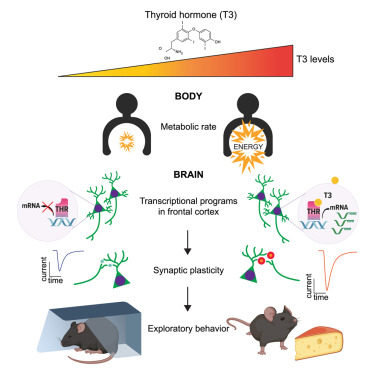
此外,当研究团队在小鼠的大脑皮层中提升甲状腺激素水平时,小鼠表现出了更强烈的探索环境和冒险的倾向。相反,当他们在大脑皮层中阻断甲状腺激素的作用时,小鼠的探索行为不再随着甲状腺激素水平的变化而改变。Hochbaum说:“这表明甲状腺激素直接在大脑皮层中发挥了重要作用。”然而,这一发现引出了一个新的问题:为什么一种主要控制代谢的激素,还能影响到大脑中控制行为的回路呢?为了解答这一疑问,研究团队参考了先前的研究成果,这些研究观察了野生动物的行为模式,并测量了狐猴、松鼠猴及其他哺乳动物的甲状腺激素水平。研究发现,在食物和资源更加丰富的温暖季节,这些动物的甲状腺激素水平较高,且它们的探索行为也更为活跃,因为此时它们的代谢率也相对更高。Hochbaum表示,这些野外研究的结果与新研究中的发现相结合,填补了甲状腺激素对大脑和身体影响的一个重要空白。他补充道:“我们认为,甲状腺激素直接作用于大脑回路,从而协调探索行为与代谢率,使得大脑和身体能够更好地适应当前的环境。”Sabatini也提到:“甲状腺激素似乎是在告诉身体,让大脑去探索并获取资源。”研究团队指出,甲状腺激素调节生理功能的方式在人类和其他哺乳动物中都非常相似,因此他们推测人类也可能存在类似的大脑-身体联动机制。事实上,该研究团队在2024年发表的一项研究显示,美国成年人中较高的甲状腺激素水平与更高的就业率和更长的工作时间相关联(PNAS, 2024, doi:10.1073/pnas.2308652121)。目前,研究团队正在印度尼西亚研究那些经历过2004年海啸的人们,目的是探究自然灾害造成的精神创伤是否会导致甲状腺激素水平的长期变化。此外,研究团队还计划进一步探索甲状腺激素增加时激活的大脑回路的生物学基础。他们希望通过这项研究能够揭示与抑郁症和躁郁症等精神疾病相关的大脑回路。Hochbaum说:“我们的设想是,这些疾病同样影响探索行为,因此通过调整甲状腺激素来改变大脑回路可能为治疗提供新的思路。”伤口愈合背后的‘液态’真相!Cell:皮肤修复过程中的组织液态化对伤口愈合至关重要
修复受伤组织的能力对于所有动物来说都是至关重要的生存技能。当身体受伤时,皮肤会通过激活、迁移及分裂皮肤干细胞的方式来完成自我修复。如果人体的伤口愈合机制出现问题,那么就可能导致慢性伤口的发生,带来严重的医疗挑战和巨大的经济成本。在一项新的研究中,布鲁塞尔自由大学干细胞与癌症实验室主任Cédric Blanpain教授领导的一个研究团队发现:在伤口愈合的过程中,皮肤的物理状态会发生从固态到液态的转变,这种变化对于组织修复极为关键。相关研究结果于2024年8月20日在线发表在Cell期刊上,论文标题为“Dynamic regulation of tissue fluidity controls skin repair during wound healing”。
为了深入理解伤口愈合时皮肤物理性质的变化及其背后的分子机制,研究团队采用了包括单细胞水平干细胞行为分析、数学模型建立、生物物理学研究以及功能性实验在内的多种研究手段。通过实时追踪体内单个荧光标记的皮肤干细胞,研究人员观察到,在伤口愈合初期,皮肤表层的物理属性经历了动态调整,变得像液体一样,使得干细胞得以扩散。随后,皮肤组织又逐渐恢复至原有的固态结构,有利于组织的再生与修复。进一步的分子分析帮助团队识别出了组织修复早期阶段的基因表达模式。他们发现,使用药物干预这些基因活动的不同组成部分,可以显著阻碍伤口愈合过程,并干扰组织从液态向固态的转变。这说明了在伤口愈合过程中,保持固态与液态之间平衡的重要性。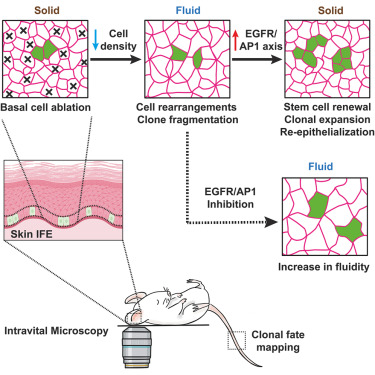
论文的第一作者Rahul M. Sarate博士指出,发现组织再生过程涉及皮肤物理性质的调节是非常令人兴奋的。而Blanpain教授则展望道,未来研究应当探索这种物理特性变化是否同样适用于其他组织的修复。他相信,通过调控组织流动性的动态变化,有望促进组织再生与伤口愈合,这对于治疗那些无法自行愈合的慢性伤口具有重要意义。
人类的肠道内平均含有大约100万亿个细菌,这些微生物为了生存而竞争有限的资源。宾夕法尼亚大学工程与应用科学学院生物工程系助理教授César de la Fuente说:“这是一个非常激烈的环境。所有这些细菌共存的同时也在互相竞争。而这种环境恰恰能够激发微生物产生新的机制。”在这种冲突中,de la Fuente实验室看到了新抗生素的潜力,如果肠道内的细菌为了生存必须发展出新的策略,那么为什么不利用这些策略来对抗它们呢?在一项新的研究中,de la Fuente实验室和斯坦福大学的Ami S. Bhatt教授对近 2000 人的肠道微生物组(gut microbiome)进行了调查,发现了数十种潜在的新抗生素。相关研究结果于2024年8月19日在线发表在Cell期刊上,论文标题为“Mining human microbiomes reveals an untapped source of peptide antibiotics”。
de la Fuente认为生物学是一种信息源。“一切都是代码,”他说,“如果我们能够开发出一种算法来解读这些代码,就能极大地加速抗生素的发现。”近年来,de la Fuente实验室因其在各种意想不到的地方发现候选抗生素而受到关注,包括已灭绝生物如尼安德特人和长毛象的遗传信息,以及利用人工智能分析大量细菌遗传物质的工作。他们的目标之一是分析全球生物信息,作为抗生素和其他有用分子的来源。他们不再依赖传统的采集土壤或水样并从中提取活性化合物的方法,而是利用基因组、宏基因组和蛋白质组中的大数据。这使得他们能够以更快的速度发现新的抗生素。考虑到细菌的快速进化,de la Fuente和他的合著者假设,一个充满竞争的环境,例如人类的肠道,可能是无数未被发现的抗菌化合物的宝库。“当资源稀缺时,生物学才会真正展现出其创新的一面,”de la Fuente说。研究团队专注于肽,即氨基酸短链,这类物质之前被证明有潜力成为新的抗生素。他们通过计算分析了超过40万种蛋白质,利用人工智能读取遗传密码,并通过训练来预测哪些遗传序列可能具有抗菌特性。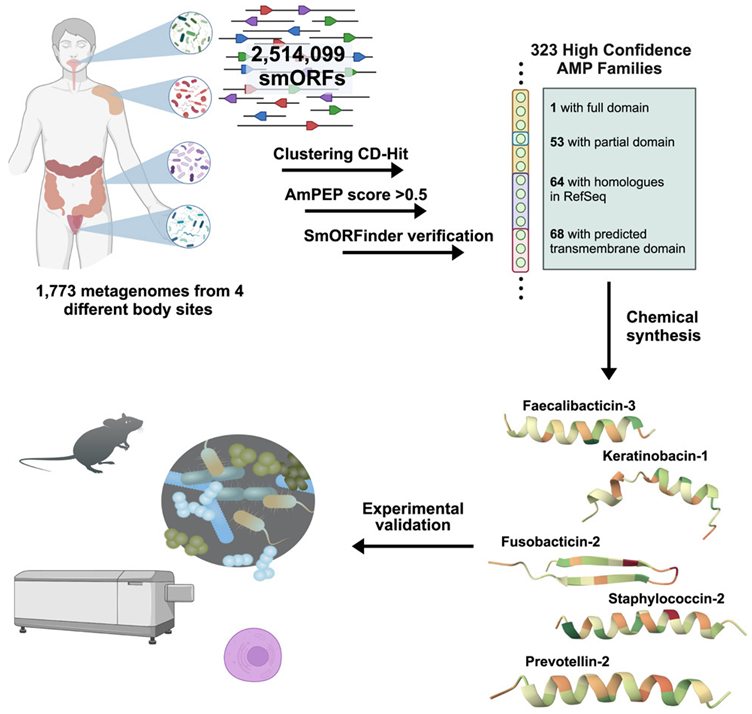
论文的第一作者,de la Fuente实验室的助理研究员Marcelo D.T. Torres指出,“这些分子的构成与传统意义上的抗生素不同。我们发现的这些化合物构成了一个新的类别,它们的独特性质将有助于我们理解和扩展抗菌剂的序列空间。”
当然,这些预测需要通过实验来验证。在筛选出数百种候选抗生素后,研究团队选择了78种进行实际细菌测试。在合成这些多肽之后,他们让细菌培养物接触到每种多肽,并观察哪种肽能成功抑制细菌生长。此外,他们还在动物模型中测试了这些候选抗生素。
结果表明超过一半的肽有效,即它们抑制了有益或有害细菌的生长,而主要候选抗生素prevotellin-2的抗感染能力与FDA批准的抗生素多粘菌素B相当,显示出人类肠道微生物组可能蕴藏着未来可用于临床治疗的抗生素。
Bhatt评论道,“prevotellin-2的活性与我们最后防线之一的多粘菌素B相当,这个发现让我感到十分惊讶。这表明,从人类微生物组中挖掘新型抗菌肽,对于科学家、医生以及患者来说,是一条极具前景的道路。”
揭示Mrc1蛋白能够在DNA复制的滞后链和前导链之间移动组蛋白
众所周知,Mrc1(Mediator of Replication Checkpoint 1)是一种在DNA复制过程中扮演重要角色的裂殖酵母蛋白。最近,由哥本哈根大学的Genevieve Thon教授和Anja Groth教授领导的一项国际合作研究,揭示了有关Mrc1蛋白的新发现。相关研究结果于2024年8月1日在线发表在Cell期刊上,论文标题为“The fork protection complex promotes parental histone recycling and epigenetic memory”。
文章的第一作者之一,Sebastian Charlton博士已经在Thon实验室研究Mrc1多年,他表示:“我们了解到这种蛋白质对于维持细胞中的异染色质状态至关重要,尽管我们已经有一定的理论认识和实验数据,但在分子水平上的验证一直是我们的一个挑战。”为了验证他们的假设,Charlton博士与来自Groth实验室的共同第一作者Valentin Flury博士合作,利用Groth实验室开发的先进基因组学技术。此外,他们还与其他机构的科学家们合作,包括诺和诺德基金会蛋白研究中心的结构生物学家,以及东京都医学科学研究所和胡伯勒支研究所的研究人员。这种跨学科的合作不仅验证了他们的假设,还揭示了Mrc1功能的另一面。Mrc1是复制叉保护复合物(FPC)的一部分,FPC是一组在DNA复制过程中至关重要的蛋白质。最新的研究发现,FPC不仅参与DNA复制,还能促进带有特定表观遗传标记的亲代组蛋白被再利用到新的DNA链上,这对于维持表观遗传记忆非常重要。Charlton博士和Flury博士的研究显示,Mrc1通过与组蛋白H3和H4形成的四聚体相互作用,作为亲代组蛋白传递的核心调节者。研究团队利用AlphaFold进行结构预测,并通过生化和功能分析验证了Mrc1和Mcm2协作结合H3-H4四聚体的过程。结果显示,Mrc1的特定结构域在组蛋白与Mcm2的连接中起到了关键作用,形成了辅助伴侣蛋白复合物(co-chaperone complex),保证组蛋白在DNA复制过程中正确地分配到滞后链上。进一步的实验表明,Mrc1通过多种方式操控组蛋白:正如前面提到的,Mrc1的一个结构域负责将组蛋白引导至滞后链,而另一个组蛋白结合区域则帮助将组蛋白转移到前导链。Charlton博士表示:“过去我们并不了解Mrc1在亲代组蛋白传递中的作用。现在,我们确认了Mrc1是确保组蛋白在两条新生DNA链间正确分配的关键。Mrc1能够在DNA复制的滞后链和前导链之间移动组蛋白,这主要是因为它在复制体内部与Mcm2协同工作。这一过程确保了两个子细胞都能获得正确的表观遗传标记,这对于细胞分裂期间维持基因表达模式至关重要。”这项研究对于理解如何维持细胞身份具有重要意义,特别是在癌症和衰老等领域。Flury博士指出,他们通过改变哺乳动物同源物Claspin中的组蛋白结合位点,观察到了类似于Mrc1突变体的亲代组蛋白传递缺陷。Flury博士总结道:“我们认为我们揭示了一个非常基础的机制,它可能对未来的医学研究产生深远的影响。”文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。
返回列表












 京公网安备 11011402010692号
京公网安备 11011402010692号




