卵母细胞减数分裂过程中的染色体分离错误会导致卵子非整倍体(aneuploidy)。这种错误发生的频率随着母体年龄的增加而增加。体细胞中较大的染色体更容易发生分离错误,而衰老的卵母细胞则不同,它更倾向于在较小的染色体上发生分离错误。卵子中较小染色体非整倍体是导致流产和先天性疾病(如唐氏综合征)的主要原因。较小的染色体是如何在衰老的卵母细胞中优先发生分离错误的,目前尚不清楚。
在一项新的研究中,为了研究单个染色体的动态变化,来自日本理化学研究所生物系统动力学研究中心的研究人员开发了一套全面的荧光探针,可特异性标记小鼠 20 条染色体(19 条常染色体和一条X 染色体)中的每一条。利用这些探针,他们建立了一个实时成像管道,可在小鼠卵母细胞减数分裂过程中对已识别的染色体进行完整的三维跟踪。通过这一“染色体识别与跟踪(chromosome identifying-and-tracking)”管道,他们从 93 个卵母细胞中获取了九条不同的已识别染色体及其着丝粒的 217 条完整的三维轨迹。利用这一全面的数据集,他们旨在定量分析基于染色体大小的时空动态,并检验它们是否会导致较小染色体的优先分离错误。相关研究结果发表在2024年7月19日的Science期刊上,论文标题为“Live chromosome identifying and tracking reveals size-based spatial pathway of meiotic errors in oocytes”。
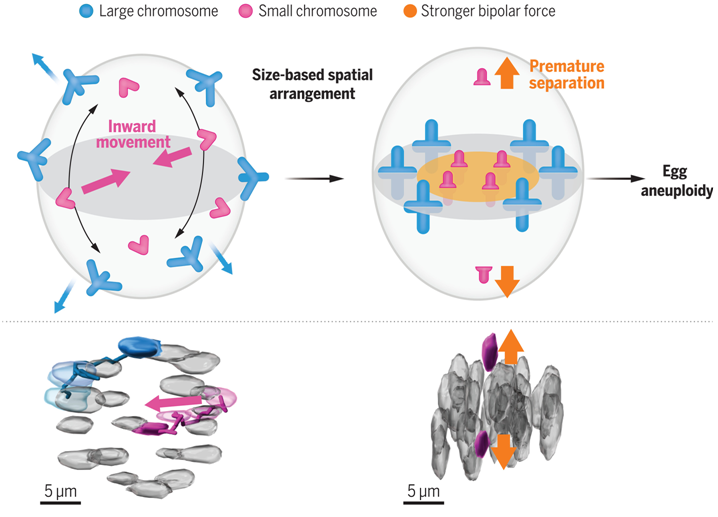
他们的定量分析发现,尽管每条染色体在卵母细胞中的动态表现出很大的差异性,但较小的染色体在减数分裂的前中期(prometaphase)更倾向于向纺锤体赤道的内部区域移动。在小鼠和人类卵母细胞中,对较小染色体的这种偏好导致建立了一种基于染色体大小的空间排列,即较小染色体优先位于中期板(metaphase plate)的内侧区域。卵母细胞可以建立这种基于染色体大小的空间排列,而不需要预先存在染色体定位偏差,这表明存在一种主动建立这种空间排列的前中期途径。这些作者发现,较小的染色体倾向于更早地伸展,而且这种伸展与较小染色体的向内运动结合得更紧密,这表明这种前中期途径涉及较小染色体上更早的双极微管附着。这种前中期途径的活跃与年龄无关。
对老龄小鼠卵母细胞的染色体追踪显示,染色体过早分离主要发生在中期板的内部区域,这是由于衰老导致染色体内聚力降低,也是造成分离错误的主要原因。染色体的过早分离取决于双极微管的拉力,而这些作者发现,在着丝粒-着丝点(kinetochore-centromere)距离增加的情况下,中期板内部区域中的双极微管拉力明显更强。用人造珠子防止较小染色体在内部定位,可显著抑制衰老的卵母细胞在较长的减数分裂中期过早发生染色体分离,这表明较小染色体优先在内部定位是衰老的卵母细胞发生分离错误的风险之一。

文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




