多囊卵巢综合征(polycystic ovarian syndrome, PCOS)是一种常见的生殖内分泌疾病,影响着 10% 至 13% 的育龄妇女,其特点是高雄激素血症、排卵功能障碍、多囊卵巢形态,并经常伴有代谢紊乱。雄激素过多是导致多囊卵巢综合症诸多表型特征的关键因素。尽管多囊卵巢综合征的发病率很高,但对这种复杂的综合征进行药物干预却面临着巨大的挑战。目前可用于多囊卵巢综合征的治疗方案非常有限,而且主要针对特定症状的管理。因此,迫切需要开发创新的治疗策略。
提取自青蒿植物的青蒿素类药物(artemisinins)因其对疟疾的疗效而广为人知。科学家们此前已证实,青蒿素及其衍生物能够通过激活产热脂肪细胞,促进能量消耗和提升胰岛素敏感性,有效阻止饮食诱发的肥胖和代谢失衡。
在一项新的研究中,来自中国复旦大学、重庆医科大学和中国药科大学的研究人员通过评估青蒿素衍生物对睾酮水平、发情周期和多囊卵巢形态的影响,探讨了青蒿素类药物在啮齿类多囊卵巢综合征样模型和人类多囊卵巢综合征患者中的治疗潜力。他们采用体外和体内方法研究了青蒿素对卵巢睾酮合成的影响,还鉴别出了青蒿素作用的直接分子靶标,揭示了其调节雄激素合成的机理。
相关研究结果发表在2024年6月14日的Science期刊上,论文标题为“Artemisinins ameliorate polycystic ovarian syndrome by mediating LONP1-CYP11A1 interaction”。论文通讯作者为复旦大学的汤其群教授。

研究者们发现,青蒿素的一种衍生物,蒿甲醚,能显著逆转多囊卵巢综合征(PCOS)模型动物中的多种症状,包括雄性激素过高、月经周期不规律、卵巢多囊样改变及生育力下降。青蒿素类药物通过减少卵巢内睾酮的产生,有效缓解了雄性激素过高的状况。利用蛋白质组学分析,他们发现,青蒿素作用后显著降低了一种关键蛋白——参与雄激素合成首步反应的细胞色素P450家族11亚家族A成员1(CYP11A1)。
从机理上讲,青蒿素类药物直接靶向离子肽酶1(lon peptidase 1, LONP1),增强了 LONP1 与 CYP11A1 之间的相互作用,促进了由 LONP1 催化的 CYP11A1 降解。相反,雄激素诱导剂会破坏 LONP1 与 CYP11A1 之间的结合。此外,LONP1 在多囊卵巢综合征中表现为明显下调,导致 CYP11A1 水平升高和雄激素合成增加。蛋白对接模拟和随后的功能实验表明青蒿素类药物对 CYP11A1 水平的抑制作用主要取决于它们与 LONP1 蛋白水解结构域的直接结合。进一步支持上述功能的是,LONP1的过表达能强有力地减少卵巢雄激素生成,这与青蒿素类药物的作用效果相符。
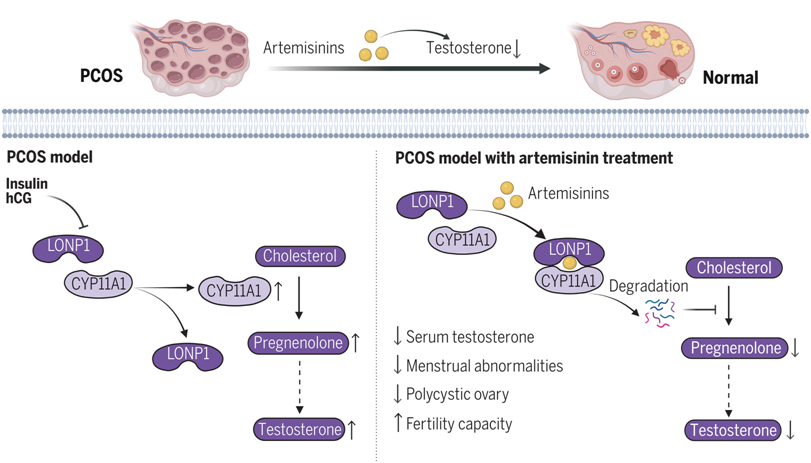
最后,为了证实青蒿素类药物对多囊卵巢综合征患者的治疗效果,研究人员进行了一项试点临床试验。他们发现双氢青蒿素(dihydroartemisinin)治疗可有效改善多囊卵巢综合征患者的高雄激素血症,降低抗缪勒氏管激素水平,改善多囊卵巢形态,并有助于月经恢复正常。
综上所述,这些数据证明了青蒿素类药物在缓解啮齿类动物模型和人类患者多囊卵巢综合征相关症状方面的功效。更重要的是,这一发现揭示了 LONP1 与 CYP11A1 之间以前未知的相互作用,且青蒿素类药物可以通过增强这一作用路径来调控雄激素合成,这为基于LONP1-CYP11A1交互作用靶向治疗PCOS提供了新的策略方向。





文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




