新的图谱针对基因如何在早期胚胎发育中起作用提供新见解
研究人员开发了一种自动系统,用于分析胚胎发生所需的基因功能,其中胚胎发生是受精卵从单细胞发育成具有皮肤、消化道、神经元和肌肉等不同组织的有机体的过程。
尽管人类基因组计划早在 20 多年前就宣布完成了 2 万个人类基因的测序工作,但科学家们仍在努力掌握基本遗传指令如何产生完整的有机体。
研究疾病如何在发育的早期阶段形成的生物医学工作,将受益于具体了解复杂生物是如何从单个受精卵细胞中产生的。在一项新的研究中,来自加州大学圣地亚哥分校的研究人员通过一种简单的模式生物,对胚胎发育如何展开有了新的认识。相关研究结果于2024年5月16日在线发表在Cell期刊上,论文标题为“Automated profiling of gene function during embryonic development”。

这些作者逐一介绍了秀丽隐杆线虫(Caenorhabditis elegans)胚胎发育过程中基因是如何发挥作用的。尽管体型微小,秀丽隐杆线虫一直是科学家们的研究对象,因为它的许多生物学特性,包括早期发育阶段,都与包括人类在内的高等生物非常相似。
论文第一作者Rebecca Green说,“通过在一种简单的模式生物中描述许多这些鲜为人知的基因,我们可以了解它们在像人类这样更复杂的系统中的作用。虽然这项研究是利用秀丽隐杆线虫完成的,但所分析的大多数基因都存在于人类中,其中许多基因的突变与人类发育障碍有关。”
这些作者开发了一种自动系统,用于分析胚胎发生所需的基因功能,其中胚胎发生是受精卵从单细胞发育成具有皮肤、消化道、神经元和肌肉等不同组织的有机体的过程。他们利用延时 4D 成像技术有条不紊地跟踪了每个基因在胚胎各个阶段的功能,包括细胞身份确定和有机体组织成形的时间。
他们使用一种称为“计算机视觉(computer vision)”的方法监控这一过程,以跟踪发育的特定方面,包括每个组织中的细胞数量。他们还跟踪了发育中有机体内组织的质量、位置和形状。
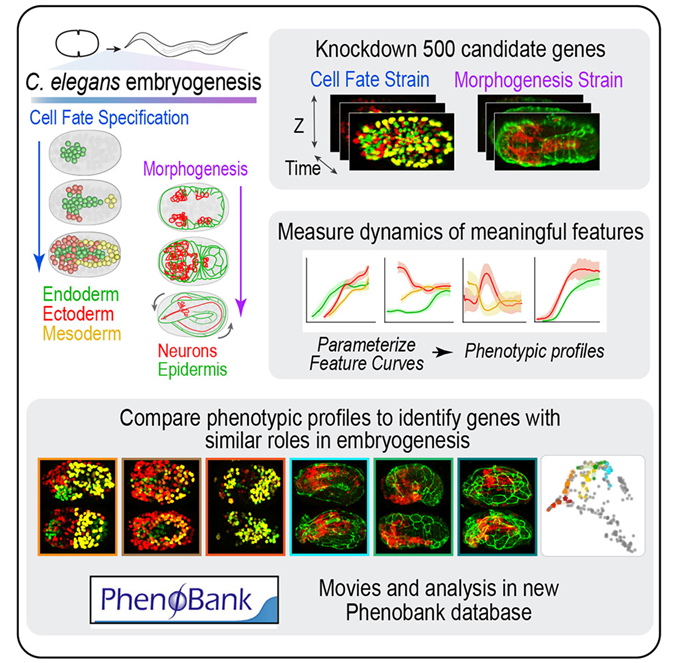
为了充分了解近 500 个对胚胎发育非常重要的基因的功能,他们逐一阻断了每个基因的功能。这样,这些作者就能将基因归入共同的基因簇,从而揭示每个基因的作用。Green将这一过程比作自动面部识别,在这一过程中,具有相似特征的图像会被组合在一起。
通过使用这个细致的过程来分析近7000个4D胚胎发生影片集,他们能够为单个基因创建 “指纹”,如细胞成为肌肉或皮肤所需的基因。这有助于他们了解这些基因在胚胎发生过程中发挥的生理作用,如控制肠道或神经系统等组织的形成。
Karen Oegema说,“我们的研究表明,我们的方法正确地对以前表征过的基因的功能进行了分类,确定了未被表征的基因的功能,并描述了新的基因和通路关系。很多我们认为功能平凡的基因被发现具有被低估的重要作用。”
来自这项研究的大量数据也促成了一个新的在线资源的推出,其中包含了所有的信息。PhenoBank如今提供了一个门户网站,可以访问这项研究期间开发的基因图谱。
Arshad Desai教授说,“这种方法令人惊奇地揭示了胚胎发生过程中代谢途径是如何专门化的,并揭示了参与基因调控的不同分子机器之间有趣的新联系。”
除了这项研究中涉及的 500 个基因外,这些作者目前正在努力完成与胚胎发生有关的全部 2000 个秀丽隐杆线虫基因的研究。
他说,“研究人员的广泛兴趣在于他们所开发的解决生物学中最具挑战性问题的方法:一个拥有大约20000个基因(与人类基因的数量相似)的基因组的单个细胞如何能够构建一个完整的有机体。”
这项研究改变了人们长期以来的看法,即这两个细胞在这一阶段对发育中胚胎的所有部分都有同样的贡献,这表明“特化”——细胞具有特定个体作用的现象,在发育过程中比以前认为的要早得多。
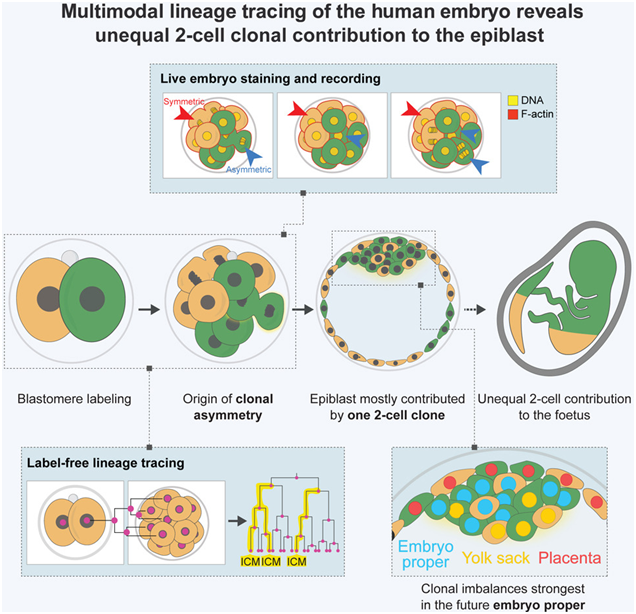
虽然已有 800 多万婴儿通过体外受精(IVF)出生,但 70% 的体外受精植入失败。随着体外受精成为不孕症患者更常见的怀孕途径,人们需要更好地了解胚胎在这一早期阶段的发育情况。在一项新的研究中,加州理工学院生物学与生物工程学的Magdalena Zernicka-Goetz教授 Magdalena Zernicka-Goetz及其团队研究了人类早期发育的基本生物过程。他们发现在胚胎刚出生 1 天时,人类胚胎由两个细胞组成,其中一个细胞除了产生胎盘细胞外,还会产生大部分胎儿体细胞,而另一个细胞只会产生胎盘细胞。相关研究结果发表在2024年5月23日的Cell期刊上,论文标题为“The first two blastomeres contribute unequally to the human embryo”。
这项研究改变了人们长期以来的看法,即这两个细胞在这一阶段对发育中胚胎的所有部分都有同样的贡献,这表明“特化(specification)”——细胞具有特定个体作用的现象,在发育过程中比以前认为的要早得多。这些发现对如何评估准备用于试管婴儿植入的胚胎是否存在异常具有重要意义。
Zernicka-Goetz说,“在试管婴儿诊所,通常会从6天大的胚胎外部选取一些胎盘细胞进行基因诊断,以确定它们是否存在染色体异常。我们的研究结果表明,根据推断,这些被选中的外部细胞不太可能对胎儿的身体做出贡献。来自这些细胞的遗传信息可能不如对胎儿细胞本身取样那么有意义。”1天大的人类胚胎仅由两个细胞组成,每个细胞称为一个卵裂球(blastomere)。这些作者利用试管婴儿诊所捐赠用于研究的胚胎,用彩色染料标记卵裂球,然后使用延时成像技术观察这两个细胞在六天内的分裂过程。新细胞带有与其母细胞相同颜色的染料。通过这一过程,他们确定胎儿的体细胞只来源于一个卵裂球,而胎盘细胞则来源于两个卵裂球。论文共同第一作者Sergi Junyent说,“除了为改进试管婴儿提供有价值的信息外,我们的研究也是对体内进化过程的大量研究的一部分。研究不同的细胞谱系如何从原始细胞中繁衍出来,对于了解突变后发生了什么、如何导致癌症等具有重要意义。”利用Perturb-seq技术大规模探究与关键发育基因相关的脑细胞类型
研究人员发明了一种名为体内Perturb-seq的新技术。这种方法利用CRISPR-Cas9技术和单细胞转录组分析,一次一个细胞地测量对细胞的影响。大脑通常被称为“黑盒子”——很难窥探其内部,也很难确定在任何特定时刻发生了什么。这也是人们难以理解神经系统疾病背后复杂的分子、细胞和基因相互作用的部分原因。但是,在一项新的研究中,来自斯克里普斯研究所的研究人员开发的一种新的 CRISPR 筛选方法有可能为这些疾病发现新的治疗靶点和治疗方法。基于此,他们以前所未有的规模快速探究与关键发育基因相关的脑细胞类型,从而有助于揭示不同神经系统疾病的基因和细胞驱动因素。相关研究结果于2024年5月20日在线发表在Science期刊上,论文标题为“Massively parallel in vivo Perturb-seq reveals cell-type-specific transcriptional networks in cortical development”。
论文通讯作者、斯克里普斯研究所神经科学系助理教授Xin Jin博士说,“我们知道,基因组中的某些突变会使我们对不同疾病变得脆弱或有抵抗力,但疾病背后是哪些特定的细胞类型?哪些大脑区域容易受到这些细胞基因组突变的影响?这些都是我们试图回答的问题。有了这项新技术,我们希望建立一个跨大脑区域、跨细胞类型、跨疾病发展时间的更动态的图像,并真正开始了解疾病是如何发生的,以及如何设计干预措施。”经过十多年在人类遗传学领域的努力,科学家们已经获得了一长串导致一系列人类疾病的基因变化清单,但了解一个基因如何导致疾病与了解如何治疗疾病本身是截然不同的。每个风险基因都可能影响一种或几种不同的细胞类型。了解这些细胞类型甚至单个细胞如何影响基因并影响疾病进展,是了解如何最终治疗该疾病的关键。正因如此,Jin与论文第一作者、斯克里普斯研究所博士生Xinhe Zheng共同发明了一种名为体内Perturb-seq的新技术。这种方法利用CRISPR-Cas9技术和单细胞转录组分析,一次一个细胞地测量对细胞的影响。利用CRISPR-Cas9,他们可以在大脑发育过程中精确改变基因组,然后利用单细胞转录组分析密切研究这些变化如何影响单个细胞——数千个细胞同时进行。Jin说,“我们的新系统可以测量单个细胞在基因扰动后的反应,这意味着我们可以描绘出某些细胞类型是否比其他细胞类型更容易受到影响,以及在发生特定突变时的不同反应。”以前,将基因扰动引入大脑组织的方法非常缓慢,往往需要几天甚至几周的时间,这为研究与神经发育相关的基因功能创造了不理想的条件。但Jin的新筛选方法可以在48小时内在活细胞中快速实现基因扰动,这意味着科学家们可以在很短的时间内迅速了解特定基因在不同类型细胞中的功能。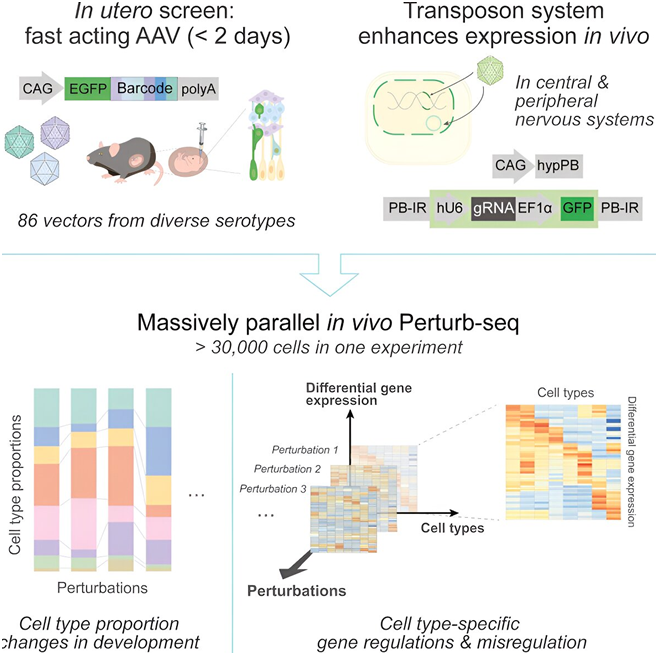
这种方法还实现了以前不可能达到的可扩展性水平,这些作者仅在一次实验中就能分析 30000 多个细胞,比传统方法快 10~20 倍。在他们研究的许多大脑区域,比如小脑,他们能够收集到数以万计的细胞,而这些细胞是以前的标记方法无法达到的。在使用这项新技术进行的一项试点研究中,当Jin和她的团队看到基因扰动在不同细胞类型中产生不同效果时,他们的兴趣被激发了出来。这一点非常重要,因为这些受影响的细胞类型是特定疾病或基因变异的作用场所。Jin说,“尽管它们的群体代表性较小,但一些低丰度细胞类型可能比其他细胞类型受到基因扰动的影响更大。这就是为什么单细胞分辨率,能够研究每一个细胞以及每一个细胞的行为,能够为我们提供一个系统的视角。”掌握了这种新技术后,Jin计划将它用于更好地了解神经精神疾病,以及某些细胞类型如何与不同的大脑区域相对应。展望未来,Jin说她很高兴看到这种技术能应用于身体其他器官的其他细胞类型,从而更好地了解组织、发育和衰老方面的各种疾病。新研究揭示ARID1A基因突变让癌症患者对免疫疗法敏感机制
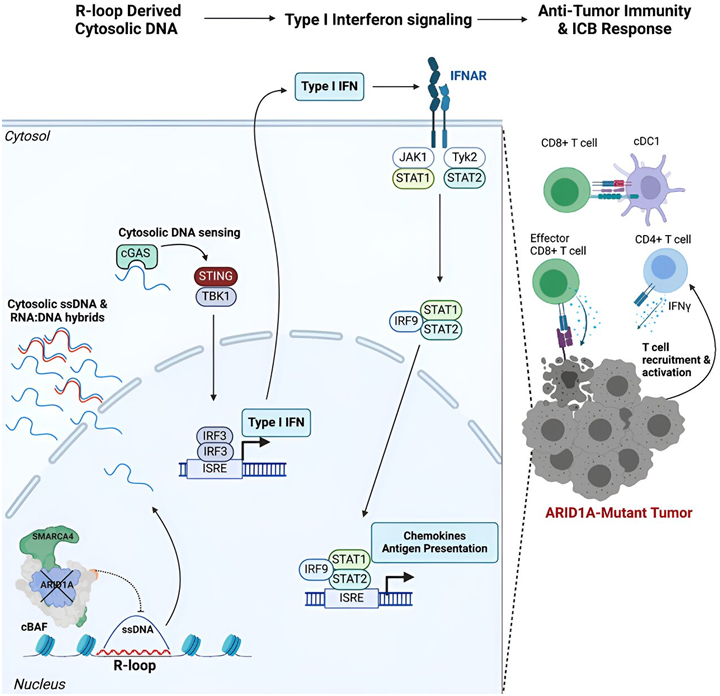
来自索尔克研究所的研究人员想知道这种突变会如何影响治疗的敏感性,以及临床医生如何利用这些信息为每位患者量身定制癌症治疗方案。近年来,免疫疗法彻底改变了我们治疗癌症的方式。免疫疗法不是靶向肿瘤本身,而是引导患者的免疫系统更有效地攻击肿瘤。这对改善某些难治癌症的治疗效果尤为有效。尽管如此,只有不到一半的癌症患者对目前的免疫疗法有反应,因此迫切需要确定生物标志物,以预测哪些患者最有可能获益。最近,科学家们注意到,肿瘤中一个名为 ARID1A 的基因发生突变的患者更有可能对免疫检查点阻断疗法产生积极反应,其中这种免疫疗法的作用原理是让称为 T 细胞的抗癌免疫细胞处于“开启”状态,否则它们就会处于“关闭”状态。由于这种ARID1A基因突变存在于许多癌症中,包括子宫内膜癌、卵巢癌、结肠癌、胃癌、肝癌和胰腺癌,因此在一项新的研究中,来自索尔克研究所的研究人员想知道这种突变会如何影响治疗的敏感性,以及临床医生如何利用这些信息为每位患者量身定制癌症治疗方案。他们发现这种ARID1A突变通过一种类似抗病毒的免疫反应将抗癌免疫细胞吸引到肿瘤中,从而使肿瘤对免疫疗法敏感。相关研究结果于2024年5月15日在线发表在Cell期刊上,论文标题为“ARID1A suppresses R-loop-mediated STING-type I interferon pathway activation of anti-tumor immunity”。
这些作者认为,这种突变和抗病毒免疫反应可能能够作为一种生物标志物,用于更好地选择接受特定免疫疗法(如免疫检查点阻断疗法)的患者。这些研究结果还鼓励开发靶向ARID1A和相关蛋白的药物,使其他肿瘤对免疫疗法敏感。论文通讯作者Diana Hargreaves副教授说,“这可能会真正改变患者的癌症治疗结果。这些ARID1A突变癌症患者已经有了免疫反应,所以我们需要做的就是利用免疫检查点阻断技术上调这种反应,帮助他们从内部摧毁肿瘤。”虽然有报道称,ARID1A突变患者对免疫检查点阻断剂反应良好,但这两者之间的确切关系仍不清楚。为了阐明这背后的机制,这些作者转而研究了黑色素瘤和结肠癌的小鼠模型,这些小鼠要么有突变的ARID1A,要么有功能性的ARID1A。他们在所有带有突变 ARID1A 肿瘤的动物模型中都观察到了强大的免疫反应,而那些带有功能性 ARID1A 肿瘤的动物模型则没有,这支持了 ARID1A 突变确实在驱动这种反应的观点。但这在分子水平上是如何起作用的呢?论文第一作者、Hargreaves实验室的研究生Matthew Maxwell说,“我们发现,ARID1A在细胞核中发挥着保持DNA正常排列的重要作用。如果没有功能性的ARID1A,松散的DNA就会被切除并逃逸到细胞质中,从而激活一种巧合的理想的抗病毒免疫反应,这种反应可以通过免疫检查点阻断进一步增强。”ARID1A 基因编码的蛋白有助于调节 DNA 的形状并保持基因组的稳定性。当ARID1A基因发生突变时,癌细胞中就会发生一连串类似于“鲁布-戈德堡机器(Rube Goldberg machine)”的微观事件。首先,缺乏功能性 ARID1A 会导致 DNA 逃逸到细胞质中。接下来,细胞质DNA 激活了抗病毒警报系统——cGAS-STING 通路,因为我们的细胞习惯于将细胞质中的任何 DNA 标记为外来物,以保护我们免受病毒感染。最后,cGAS-STING 通路呼吁免疫系统招募 T 细胞进入肿瘤,并将它们激活为特化的杀癌 T 细胞。每一步都依赖于上一步,这一系列事件——ARID1A突变、DNA逃逸、cGAS-STING警报、T细胞招募,导致肿瘤中出现更多的抗癌T细胞。然后,免疫检查点阻断剂可用于确保这些T细胞保持“开启”状态,使它们更有能力战胜癌症。Hargreaves说,“我们的发现提供了一种新的分子机制,通过这种机制,ARID1A突变可以促进抗肿瘤免疫反应。这些结果最令人兴奋的是它们的转化潜力。我们不仅可以利用ARID1A突变来帮助选择接受免疫检查点阻断治疗的患者,而且我们如今还看到了一种机制,可以利用抑制ARID1A或其蛋白复合物的药物来进一步增强其他患者的免疫疗法。”通过概述免疫检查点阻断对ARID1A突变癌症更有效的机制,这些作者为临床医生优先考虑对ARID1A突变患者进行免疫治疗提供了依据。这些发现是实现癌症治疗个性化的重要一步,也为开发靶向和抑制ARID1A及其蛋白复合物的新型疗法提供了灵感。在未来,这些作者希望他们的发现能够改善与ARID1A突变相关的多种癌症类型的患者预后,并将探索对他们的发现进行临床转化。文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。
返回列表











 京公网安备 11011402010692号
京公网安备 11011402010692号




