想象一下,通过另一物种的眼睛看世界会是怎样一番景象?如今,这不再是科幻小说的情节!
在一项新的研究中,美国哥伦比亚大学Kristin Baldwin教授领导的一个研究团队成功构建了拥有“混血大脑”的小鼠,它们能利用大鼠的神经元来感知气味。这是动物首次能够利用另一种动物的感觉器官来感知世界并做出准确反应,同时也表明了大脑在整合外部脑细胞方面的灵活性。相关研究结果发表在2024年4月25日的Cell期刊上,论文标题为“Functional sensory circuits built from neurons of two species”。

Baldwin说,“这项研究开始向我们展示,我们如何扩大大脑的灵活性,使其能够容纳来自人机界面或移植干细胞的其他类型输入。”
杂合目标
了解和治疗人类大脑疾病的最大挑战之一是,目前的研究方法不可能完全了解这些疾病。Baldwin说,“我们有漂亮的培养皿细胞模型和称为类器官的三维培养物,它们都有各自的优点,但单一的它们都无法让你确定细胞是否在最高水平上运作。”
杂合大脑将使得人们更好地了解脑细胞是如何生病或死亡的,并更好地了解修复和替换部分大脑的规则。她补充说,“如今,科学家们正在将干细胞和神经元移植到帕金森病和癫痫患者体内。但我们并不真正了解这样做的效果如何。有了杂合大脑模型,我们就能开始得到一些答案,而且速度比临床试验更快。”
构建杂合大脑
人们以前曾通过注射神经元或移植豌豆大小的脑类器官到小鼠或大鼠发育中的大脑或完全成型的大脑中来构建杂合大脑。
研究团队采用了前沿的“囊胚互补”技术,将大鼠干细胞注入小鼠早期胚胎中,使两种物种的细胞得以共生并自然整合,克服了传统移植技术的局限性。这一过程如同在小鼠大脑中巧妙植入了大鼠的嗅觉系统,使改造后的小鼠能够依靠“外来”神经元找到隐藏的食物,证明了大鼠神经元在小鼠大脑中的功能整合。
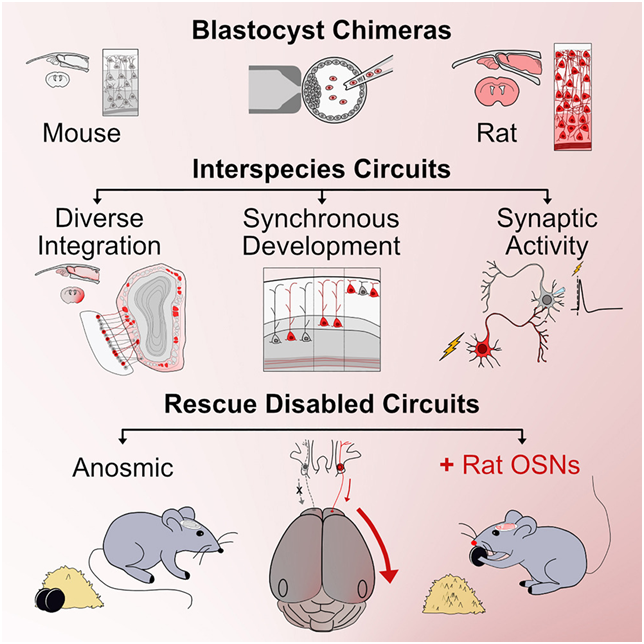
这种称为囊胚互补(blastocyst complementation)的技术类似于制造具有人类免疫系统的小鼠的技术,后者已被证实是强大的研究工具。但在这项研究之前,这种技术还不能成功地制造出两个不同物种的杂合大脑。Baldwin说,“我们正在做的是真正的前沿技术。”
大鼠神经元恢复了小鼠的嗅觉
在这些作者的首次杂合实验中,他们研究了小鼠大脑中出现大鼠神经元的位置。大鼠的发育速度较慢,大脑较大,但在小鼠体内,大鼠细胞遵循小鼠的指示,加速发育,并建立与小鼠细胞相同的连接。
Baldwin说,“你几乎可以在整个小鼠大脑中看到大鼠细胞,这让我们相当惊讶。这告诉我们,将它们插入的障碍很少,这表明许多种小鼠神经元都可以被类似的大鼠神经元取代。”
这些作者随后研究了大鼠神经元是否被整合到了一种功能神经回路中,在这种情况下,大鼠神经元被整合到了嗅觉系统的一部分,而嗅觉系统对于小鼠寻找食物和躲避捕食者至关重要。通过对小鼠胚胎进行工程改造,使其自身的嗅觉神经元死亡或失活,他们就能轻松确定大鼠神经元是否恢复了它们的嗅觉。
Baldwin说,“”我们在每只小鼠的笼子里都藏了一块饼干,我们非常惊讶地发现,它们能用大鼠神经元找到饼干。”
不过,有些小鼠比其他小鼠更善于寻找饼干。研究人员发现,与嗅觉神经元在发育过程中经过基因改造后消失的小鼠相比,保留了自己的、沉默的嗅觉神经元的小鼠在寻找隐藏的饼干时成功率较低。
Baldwin,“这表明添加替代性神经元并非即插即用。如果你想获得功能性替代神经元,你可能需要清空呆在那里的功能障碍神经元,这可能是某些神经退行性疾病的情况,也可能是自闭症和精神分裂症等神经发育障碍的情况。”
有了Baldwin团队构建的这种杂合大脑系统,科学家们如今可以利用小鼠仔细剖析不同模型中发生的情况,这最终可能有助于提高人类细胞移植的成功率。
灵长类动物杂合体?
这种新的杂合大脑系统的一个缺点是,大鼠细胞在每只不同小鼠体内的分布是随机的,这阻碍了将这些研究推广到大脑的其他感觉和神经系统。Baldwin实验室目前正在努力寻找方法,促使导入的细胞只发育成一种细胞类型,这样就可以进行更精确的实验。
如果导入的细胞在杂合大脑中的发育能够受到限制,那么这也将为构建具有灵长类动物神经元的杂合大脑打开大门。Baldwin,“这将帮助我们更了解人类疾病。”
人类肠道菌群中的隐性质粒有望成为识别水体粪便污染、炎症性肠病等健康问题的强大生物标志物
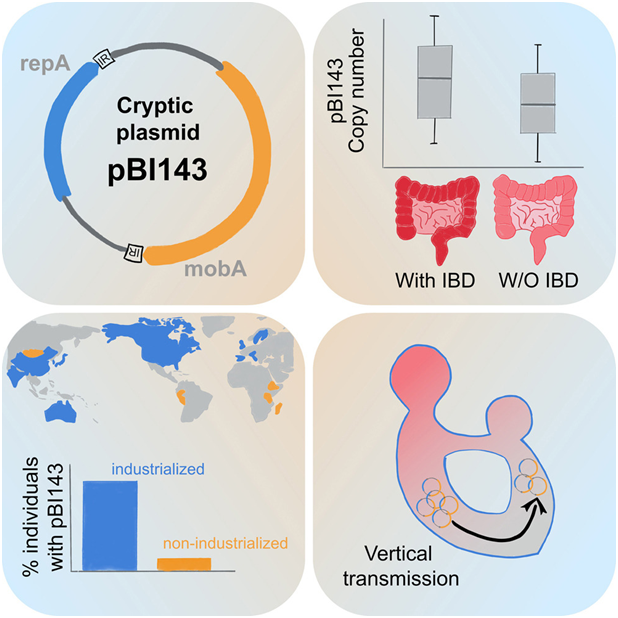
研究人员发现,在工业化国家,90% 以上的人都携带这种隐性质粒,平均而言,它是人类肠道中数量最多的基因实体之一。在一项新的研究中,德国奥尔登堡大学亥姆霍兹海洋生物功能多样性研究所的A. Murat Eren教授领导的一个国际研究小组聚焦于人类肠道菌群中的一种成分:质粒,在此之前人们对它的研究很少。质粒是一种小型染色体外遗传元件,广泛存在于细菌细胞中,对微生物生活方式具有深远影响,但其在自然生态环境中的多样性却知之甚少。在这项新的研究中,他们发现一种神秘的质粒是人类肠道中数量最多的遗传因子之一。这种质粒有可能成为一种强大的生物标志物,用于识别水的粪便污染等健康危害或炎症性肠病等人类疾病。根据他们的分析,这种质粒存在于工业化国家 90% 以上的人的肠道中。相关研究结果近期发表在Cell期刊上,论文标题为“A cryptic plasmid is among the most numerous genetic elements in the human gut”。

质粒是染色体外的DNA序列,在所有生命领域的细胞中都很常见。Eren将其描述为“携带额外基因的典型小型遗传实体”。它们可以在不同的细菌细胞之间甚至不同类型的细菌之间交换。质粒的复制依赖于宿主细胞,但在某些情况下,它们为宿主提供了极其重要的适应性决定因素,从而弥补了宿主细胞的不足。例如,有些质粒含有编码抗生素耐药性的基因,助力细菌在抗生素环境中生存,成为全球公共卫生的重大挑战之一。
根据迄今为止的研究,还有一些质粒并不含有编码对宿主明显有益功能的基因。Eren解释说,“这些所谓的‘隐性质粒(cryptic plasmid)’通常被称为基因寄生虫。它们仍然是微生物生态学中的一个谜,因为从进化的角度来看,它们根本就不应该存在。”迄今为止,识别质粒一直是一项艰巨的任务。一段时间以来,科学家们已能够直接从环境样本中提取遗传物质,例如,无需培养单个细菌生物,就能对人类肠道中的微生物群落进行整体分析。然而,在这些称为“宏基因组(metagenome)”的遗传物质集合体中,如何有把握地分辨出什么是质粒仍是一个相当大的挑战。为了解决这个问题,Eren和他的同事们开发了一种新的机器学习方法。他们近期发表在Nature Microbiology期刊上的另一篇论文中报告说,他们利用这种方法识别出了人类肠道菌群中的68000多个质粒,其中一种名为pBI143的隐性质粒在数据集中尤为丰富(Nature Microbiology, 2024, doi:10.1038/s41564-024-01610-3)。在这项新的研究中,他们仔细研究了这种隐性质粒,它只由两个基因组成,令人惊讶的是,这两个基因只能用于自身复制和在细菌细胞中移动,而没有其他明显的益处。为了更好地了解 pBI143 的生态学,他们分析了从不同栖息地产生的 6 万个人类宏基因组和 4 万个环境宏基因组。Eren解释说,“我们发现 pBI143 有一系列非常有趣的特征。”他们发现,在工业化国家,90% 以上的人都携带这种隐性质粒,平均而言,它是人类肠道中数量最多的基因实体之一。他说,“平均而言,它的数量是病毒基因组的 10 倍以上,而病毒基因组以前被认为是人类肠道中数量最多的染色体外遗传物质。”进一步的分析表明,这种隐性质粒几乎只出现在人类肠道中,但在海洋、土壤、植物和动物消化器官及其粪便等其他环境的数据集中几乎不存在。除受人类活动影响的环境如废水、医院表面和实验室大鼠样本外,研究人员仅能在极少数样本中检测到其特征基因序列。由于pBI143的数量庞大,在人类中普遍存在,而且在人类种群中具有保守性,这些作者假设,pBI143可以用作检测粪便污染的生物标志物。Eren教授肯定道:“事实证明,相较于基于人类肠道细菌特定基因序列的先进生物标志物,pBI143在检测饮用水中粪便污染方面更为灵敏。”此外,研究者还揭示了这种普遍存在的基因实体在炎症性肠病(IBD)等人类疾病中的潜在应用价值。他们发现,与健康人相比,IBD患者肠道中pBI143的相对拷贝数近乎翻了四倍,暗示质粒拷贝数的变化可能作为量化疾病进展或严重程度的非侵入性指标。Eren团队正在计算机科学和微生物学的交叉领域开发新的工具,以识别和描述生活在海洋中的细菌中天然存在的质粒和其他可移动遗传元件。他们致力于更好地了解微生物的生态学和进化,揭示微生物应对环境变化的策略,从而实现新的生物技术应用,改善我们面临的危机。
利用新开发的显微镜技术FLASH-PAINT观察复杂的细胞内部运作
来自美国耶鲁大学的研究人员开发了一种革命性的显微镜技术——“FLASH-PAINT”,它为我们揭开单个细胞内部运作的神秘面纱提供了前所未有的视角。试想观看一场橄榄球赛,除了两名四分卫,其余球员皆隐身不见,如此一来,观众将难以理解全队的协同战术。同样,科学家在显微镜下探索细胞内部世界时,也面临着类似困境。细胞内部是一个由数百万分子构成的精密生态系统,它们相互作用、协同工作,而要清晰观察细胞器、蛋白质及其他微小亚细胞成分,必须依赖超分辨率显微镜。遗憾的是,当前技术仅能让我们同时观察有限的目标。在一项新的研究中,来自美国耶鲁大学的研究人员开发了一种革命性的显微镜技术——“FLASH-PAINT”,它为我们揭开单个细胞内部运作的神秘面纱提供了前所未有的视角。这项技术的核心在于对成像探针的创新应用,通过在生物样本中使用特定化合物,显著提升科学家对微小细节的探测能力。相关研究结果发表在2024年3月28日的Cell期刊上,论文标题为“Unraveling cellular complexity with transient adapters in highly multiplexed super-resolution imaging”。
论文共同通讯作者、耶鲁大学细胞生物学教授Joerg Bewersdorf博士说,“若仅能观察一两蛋白,就如同管窥蠡测,难以洞察全局。而今,我们拥有一种优雅且高效的手段,可以随心所欲地对几乎无限数量的蛋白质和其他特征进行成像。”
新型成像探针能瞬时结合无限数量的分子
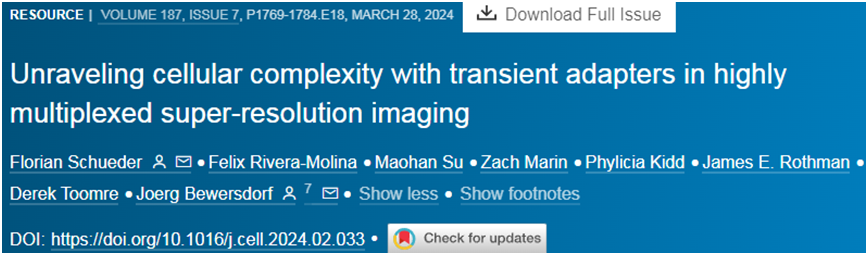
目前一种可视化观察细胞内部过程的方法是将抗体与由单链 DNA 和荧光染料组成的成像探针结合使用。抗体引导探针到达需要成像的靶标,DNA 链与抗体上的互补“对接”DNA 链结合。
这种方法的一个局限是,每个靶标都需要它自己的成像探针。例如,如果一个团队想观察 10 种不同的靶标,就需要使用 10 种探针。论文第一作者、耶鲁大学细胞生物学副研究员Florian Schüder 博士说,“但是如果我们的设想是对细胞中的每种蛋白进行成像,那么大约有 2 万种不同的蛋白。”他说,“设想对细胞内所有2万余种蛋白质进行成像,现有技术显然无法胜任。”
为解决这一难题,研究团队引入了一种名为“衔接分子”(adapter)的中介物质,它能灵活连接任意类型的探针与任意类型的靶标。这项技术的关键在于,衔接分子与靶标的结合极为短暂,易于从一个靶标迅速转换至下一个。“这种快速切换能力至关重要,”Bewersdorf强调。
快速、低成本的显微镜技术为新发现铺平了道路
“瞬时结合”与“广泛连接”的特性使得FLASH-PAINT技术的速度提升百倍,且成本仅为现行超分辨率显微镜技术的极小部分。“这将极大地加速科学发现的步伐,”Bewersdorf说,“现在,我们只需一次实验就能揭示所有可能的相互作用,而非反复实验只为观察一两种蛋白间的单一交互。”
研究团队期待FLASH-PAINT能让我们直观呈现以往无法触及的复杂亚细胞过程,从而助力临床医生更好地理解并治疗包括癌症在内的多种疾病。“与疾病较量需要全面审视所有参与者,唯有如此,方能洞悉全局,”Bewersdorf表示。在未来的探索中,研究人员将进一步研究FLASH-PAINT在组织成像及作为诊断工具的应用潜力,这场细胞内部世界的“高清直播”正缓缓拉开帷幕,引领我们步入生命科学的新纪元。
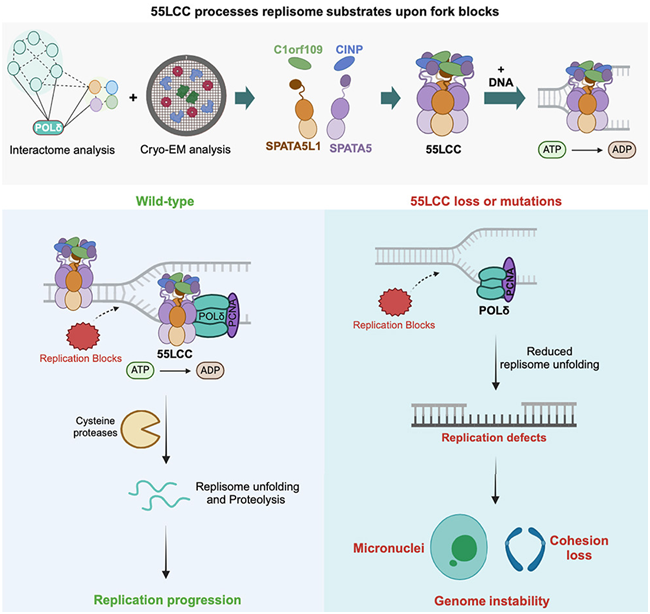
在这项新的研究中,研究人员利用低温电镜、基于CRISPR的突变分析和其他先进技术,确定了一种蛋白复合物,这种复合物在滞后链的复制停止过程中发挥着核心作用。人体细胞分裂时,必须首先准确复制它的DNA。DNA 复制工作是所有生物体内最重要的过程之一,充满了突变的风险,可能导致细胞死亡或癌症。如今,在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院和英国利兹大学的研究人员发现了细胞中的一种多蛋白“机器”,它能帮助控制 DNA 复制的暂停或停止,以确保DNA复制的顺利进行。这一发现加深了人们对DNA复制的理解,有助于解释一系列令人费解的遗传疾病,并可能为未来开发针对神经和发育疾病的治疗方法提供信息。相关研究结果于2024年3月29日在线发表在Cell期刊上,论文标题为“The SPATA5-SPATA5L1 ATPase complex directs replisome proteostasis to ensure genome integrity”。
论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院癌症生物学系教授Roger Greenberg 博士说,“我们发现了细胞中的一种关键质量控制机制。我们体内每天都有数万亿个细胞进行分裂,这就需要准确复制我们的基因组。我们的研究描述了一种调节复制 DNA 中蛋白稳定性的新机制。我们如今对这一复杂生物过程中的一个重要步骤有了更多的了解。”DNA“滞后链(lagging strand)”复制的不解之谜
DNA 复制过程由多种具有高度专业化功能的蛋白复合物完成,包括 DNA 的解旋和两条解旋的DNA 链的复制。这个过程类似于工厂的装配线,由大量摺皱的数据线组成的球被解开,允许特定的片段被修剪和复制。生物学家对这一过程如何开始和进行了解颇多,但对其如何停止或暂停却知之甚少。
先前的研究已确定了一些蛋白,它们通过诱导 DNA 复制组分在一条 DNA 链——前导链(leading strand)上的分解和再循环,来阻止该链上的复制。另一条DNA链——滞后链上的DNA复制是如何停止的,一直是个谜。在这项新的研究中,这些作者利用低温电镜、基于CRISPR的突变分析和其他先进技术,确定了一种蛋白复合物,这种复合物在滞后链的复制停止过程中发挥着核心作用。他们发现这种称为 55LCC 的四蛋白机器能与 DNA 及其相关的复制复合物结合。在两种称为 ATP 酶的马达样酶(motor-like enzyme)的驱动下,55LCC 似乎能让原本紧密折叠的复制复合物去折叠,使其被蛋白切割酶切碎并清除。这些实验表明,55LCC 的这种停止或暂停功能对于 DNA 复制的顺利进行至关重要。这些作者发现当55LCC缺失时,DNA复制很可能会被卡住,受影响的细胞会停止分裂。Greenberg说,“我们最终看到这些细胞的基因组稳定性发生了巨大变化,因为它们的染色体在细胞分裂过程中无法正常分离。”这些作者猜测55LCC不仅可能参与调节与细胞分裂相关的DNA复制过程,还可能在DNA损伤性病变阻断DNA复制时也是如此。基础科学发现的临床意义
众所周知,构成55LCC的酶的遗传突变与儿童综合症有关,包括听力损失、认知和运动障碍以及癫痫。这些作者在实验中发现,这些致病突变往往会降低55LCC的结构稳定性或影响它与其他蛋白的相互作用。
Greenberg说,“这项研究有望标志着人们开始更深入地了解这些严重的神经发育综合征。最终,这一发现的影响可能会更广泛。它可能导致人们找到缓解与包括癫痫、听力损失、智力迟钝和骨髓功能不全在内的55LCC功能障碍综合征相关的临床问题的方法。”
55LCC还可能成为蛋白循环利用的一种更普遍的工具,其中蛋白循环利用是对细胞健康至关重要的另一个过程。Greenberg和他的团队正在继续研究 55LCC 的作用机制和调控方式,包括了解让55LCC 变得活跃并开始让DNA 复制复合物去折叠的精确信号。
返回列表











 京公网安备 11011402010692号
京公网安备 11011402010692号




