该候选药物的发现为 2 型糖尿病和肥胖治疗提供了全新的思路和选择,有望改善数百万患者的代谢健康,提高患者的生活质量。

研究人员采用基于配体的虚拟筛选和化学进化方法,开发了一系列具有不同信号特征的β2AR激动剂。这些化合物在增加葡萄糖摄取的同时,最大限度地减少 cAMP 生成,并在多种细胞系中显示出较低的心脏和肌肉副作用潜力。
他们发现,这些化合物对 GPCR 激酶 GRK2 具有选择性偏好,能以 GRK2 依赖、胰岛素非依赖的方式促进肌肉葡萄糖摄取,并且在多种组织中表现出与 GLP-1 受体激动剂和二肽基肽酶 4(DPP-4)抑制剂不同的代谢调节作用。此外,这些化合物在细胞水平上展现出比现有药物更高的葡萄糖摄取效率。
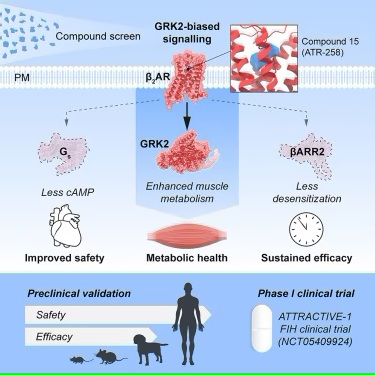
一项涉及 48 名健康受试者和 25 名 2 型糖尿病患者的 I 期临床试验表明,人类对该治疗方案的耐受性良好。受试者没有出现显著的体温、呼吸率变化,也没有出现血液学异常、低血糖、低血钾或其他电解质失衡等严重不良事件。心脏肌钙蛋白 I 水平始终低于参考范围,表明该药物对心脏安全性较高。此外,该药物在健康志愿者和糖尿病患者中的药代动力学特征相似,具有快速吸收和约 10 小时的末端血浆半衰期,且口服生物利用度高,主要通过肾脏排泄。
研究人员表示,这种候选药物不仅可作为单一治疗方案,还可与 GLP-1 类药物联合使用。该候选药物的发现为 2 型糖尿病和肥胖治疗提供了全新的思路和选择,有望改善数百万患者的代谢健康,提高患者的生活质量。目前,该候选药物已经进入 II 期临床试验阶段,旨在进一步验证其在 2 型糖尿病和肥胖患者中的疗效和安全性。
Izar团队开发的方法旨在揭示导致APDS的遗传变异——这是一种由两个对免疫细胞功能至关重要的基因之一发生特定突变引发的遗传性疾病。
在一项新的研究中,来自哥伦比亚大学瓦格洛斯内科与外科学院的研究人员开发出一种新型实验室检测方法,可能帮助医生更快诊断疑似遗传性免疫疾病患者,其中的许多患者多年来深陷诊断困境。他们将该方法应用于一种罕见先天免疫缺陷——活化磷脂酰肌醇3-激酶δ综合征(activated-PI3Kδ syndrome, APDS),从中发现了数十种可引发这种综合征的新型基因变异。相关研究结果发表在《细胞》杂志上。

论文共同通讯作者Benjamin Izar说,“我们的成果为医生提供了快速诊断和治疗患者的资源,避免了繁琐检测和延误治疗的长周期诊断过程。”论文第一作者Zachary Walsh补充道,“对APDS患者而言,快速诊断尤为关键,因为已有获得美国食品药品管理局(FDA)批准的精准疗法可用。”
这些发现对患者的生命产生了实时影响。在这些研究结果的指导下,一名患者被诊断为APDS,这种疾病会导致广泛的健康问题,包括感染、自身免疫性疾病,以及在年轻时患某些癌症的风险增加。这名患者现在正在接受精准治疗,即一种名为leniolisib的药物,该药物功能异常的PI3Kδ蛋白。
Izar强调,“我们相信还有更多待发现的病例。”基于研究APDS时取得的成功,Izar及其团队正与哥伦比亚大学儿科系Joshua Milner、Dusan Bogunovic教授合作,将该方法拓展至其他罕见免疫疾病领域。Walsh指出,“该方法可能适用于众多疾病领域,这项新的研究或仅是冰山一角。”
医学中的基因检测模糊性问题
Izar团队开发的方法旨在揭示导致APDS的遗传变异——这是一种由两个对免疫细胞功能至关重要的基因之一发生特定突变引发的遗传性疾病。
当基因检测显示已知的APDS致病变异时,患者即被确诊为APDS,从而有资格接受针对这种综合征的唯一靶向药物leniolisib治疗。但基因检测结果常存在模糊性:每个已知致病变异对应着数百个尚未分类的意义未明变异(variants of uncertain significance, VUS)。
Izar指出,“核心问题在于无法判断VUS是否与患者病症相关,或仅反映个体间正常差异,这给临床决策带来重大挑战与不确定性。”
新方法破解遗传不确定性
为加速APDS中VUS的功能评估,研究人员采用CRISPR碱基编辑器在APDS基因中构建数千种突变,然后在实验室中测量每种变异对人类健康T细胞的影响。引发T细胞中APDS相关变化的变异归类为功能获得性,经临床观察后可能能够进一步确认为致病性。
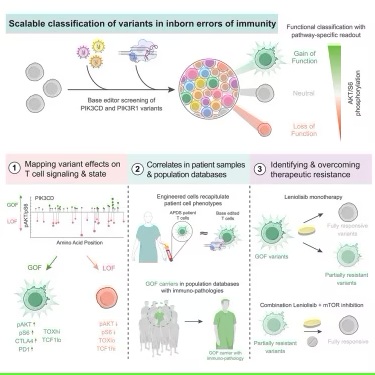
Walsh强调,“我们的研究之所以如此强大,是因为我们有能力在基因中构建数千种变异,无论这些变异是否曾在患者身上出现过。通过主动对变异进行分类,甚至在患者身上发现变异之前,我们希望我们能在VUS问题之前解决问题。”
Izar说,“除了罕见的疾病,这些方法可能开启人类基因组计划2.0时代,我们不仅可以描述一种变异是否存在,还可以开始了解这种遗传变异,无论是单独的还是组合的,是否对给定的表型有影响。”
APDS实际患病率或被低估
尽管美国预计仅有数百名APDS患者,但基于数十万基因组分析,这项新研究表明APDS可能比之前估计的要常见得多,可能每10,000个美国人中就有一个受到影响。研究人员发现在“我们所有人(All of Us)”精准医疗项目中,每5000名美国人中就有1人存在潜在的功能获得性变异。该项目已经对超过63万名美国人的基因组进行了测序。一些携带这些变异的人的症状与健康记录中记录的APDS一致,但没有被诊断出患有这种综合征。
Izar说,“这些人可能症状较轻,但可能从新的靶向治疗中受益。医生需要更加了解这种综合征的症状,这样更多的患者才能接受基因检测并得到诊断。”
Walsh说,“这些发现还提示着,许多极其罕见或罕见的遗传疾病可能并不像我们想象的那么罕见。我们为APDS开发的框架可能应用于许多其他疾病,无论是罕见的还是更常见的,以识别更多的致病变异和更多的患者,并更好地了解这些疾病的真实患病率。”
某些癌症和慢性炎症性疾病通过免疫疗法治疗。这些疗法刺激患者免疫系统识别并摧毁肿瘤细胞。为改进此类治疗,科学家们正探索触发免疫反应的相关机制。

病毒是重要的研究工具。汉诺威医学院病毒学研究所所长Lars Dölken教授团队开发的病毒突变体为这项研究提供了关键支持。该研究由法国居里研究所的Nicolas Manel教授和Xavier Lahaye博士主导,与Daniele Fachinetti教授团队合作完成。
这项研究采用引发唇疱疹的1型单纯疱疹病毒(HSV-1)。疱疹病毒因可侵入细胞核而具有特殊研究价值。它们能感染宿主细胞、劫持细胞功能并触发强烈免疫反应。
cGAS-cGAMP-STING通路对抗病毒免疫至关重要。尽管细胞质cGAS可检测病毒DNA,但大多数DNA病毒会屏蔽其基因组并侵入细胞核,在那里染色质限制了cGAS的激活。病毒如何激活细胞核中的cGAS尚不明确。
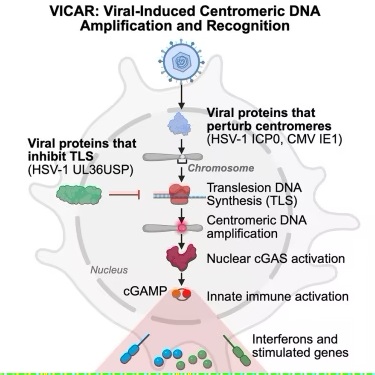
这项新研究揭示,多种疱疹病毒蛋白通过扰动cGAS富集的着丝粒来激活细胞核中的cGAS。HSV-1的泛素连接酶ICP0会降解着丝粒蛋白,在静息单核细胞衍生性的细胞中通过TLS途径促进着丝粒DNA扩增,从而激活细胞核中的cGAS。在感染过程中,HSV-1通过表达TLS抑制因子UL36USP逃避这种检测。与ICP0相类似的是,巨细胞病毒的IE1蛋白也导致着丝粒DNA扩增和cGAS激活。因此,研究人员将这种机制定义为病毒诱导的着丝粒DNA扩增与识别(viral-induced centromeric DNA amplification and recognition, VICAR),揭示了着丝粒在非有丝分裂中的免疫激活作用。
Dölken教授解释说,“Manel教授团队发现,侵入细胞核的病毒会破坏着丝粒稳定性,导致这些染色体区域发生选择性DNA复制。这种异常的DNA复制被细胞识别后,会激活细胞自身免疫系统,从而引发系统性抗病毒反应。目前期望通过识别和破译该机制,开发针对病毒或癌症的新型免疫疗法。”
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




