研究人员得出结论:链滑动可保持基因组结构,并可能帮助流感病毒躲避免疫传感蛋白的监测。阻断这种尾环接触可能阻止这种躲避,为研制泛流感药物提供新的途径。
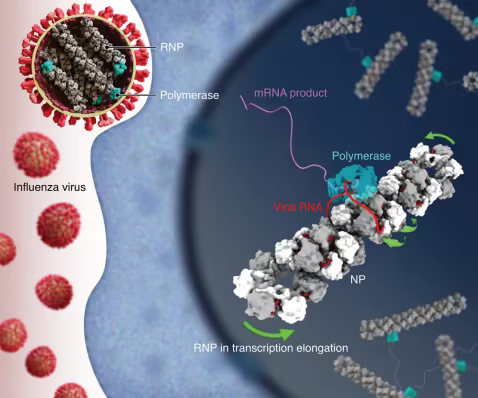
在一项新的研究中,宾夕法尼亚大学研究人员在流感病毒核糖核蛋白复合体(RNP)中发现了一种右旋反平行双螺旋结构。该结构能够在病毒聚合酶复制RNA时实现链间滑动,为开发靶向保守位点的广谱抗病毒药物提供了新方向。相关研究结果发表在Science杂志上。

季节性流感每年导致290000-650000例死亡。现有疫苗和大多数抗病毒药物靶向病毒表面蛋白,但这些蛋白每个流行季都会发生快速变异,导致保护效果减弱。而流感病毒核心分子机器——核蛋白(NP)和RNA聚合酶的结构特征尚未解析,阻碍了广谱药物的研发。
在这项研究中,研究人员整合了低温电镜单颗粒分析和低温电子断层扫描技术,揭示了NP链与RNA聚合酶如何协同完成持续性RNA合成。
通过对 17414 张数字显微照片的分析,确定了 516476 个重组丁型流感病毒非结构片段颗粒和 5738 个天然甲型流感病毒细丝,生成了四个 NP 亚基的 5.1 Å 重构图和另外六个构象的亚纳米图。
研究方法包括在 HEK293T 肾细胞内组装最短的病毒片段,通过串联亲和和甘油梯度纯化完整的复合物,然后在 300 千伏的 Titan Krios上成像,并使用氧化石墨烯支架保护脆弱的RNA聚合酶-NP 接触处。


如今,来自霍华德-休斯医学研究所和哈佛大学的研究人员破译了星形胶质细胞与神经元之间的沟通,揭示了星形胶质细胞如何触发一种生化回路,从而调节神经元的活动,使斑马鱼停止游泳。他们的发现表明非神经元星形胶质细胞在调节神经元及其连接的活动中发挥着主导作用。相关研究结果发表在Science杂志上。
尽管神经递质能使单个神经元之间进行持续几毫秒的快速交流,而像这项新研究中发现的这种生化回路这样的神经调节剂则作用于神经元群体,在慢一千倍以上的时间尺度上调节神经元信号,从而在几秒到几分钟的时间尺度上实现灵活的行为。
这项新研究有助于揭示这类神经调节剂是如何到达神经元的,并揭示了星状胶质细胞在神经调节中的重要作用。这也凸显了将非神经元细胞的信息纳入大脑工作原理研究中的重要性。
论文第一作者兼论文共同通讯作者Alex Chen说,“我认为流行的观点是,许多对行为很重要的计算都来自于神经元之间的连接模式。这项研究表明,我们必须了解生化计算和其他形式的非神经元信息,并将其与神经元之间的连接信息结合起来,才能真正了解大脑在做什么。”
论文共同通讯作者Misha Ahrens说,了解神经调节剂如何从星形胶质细胞流向神经元,对于治疗精神疾病也很重要。
Ahrens说,“在精神疾病研究中更频繁地包括这些通路非常有意义。了解到大脑功能和功能障碍背后的许多神经调节都是通过星形胶质细胞进行的,这就支持将这一新的细胞群体视为潜在的治疗靶点。”
揭示沟通
这项新研究建立在同样由Ahrens实验室2019 年领导的一项研究的基础上,当时他们揭示了放射状星形胶质细胞在“放弃”行为中的作用:当斑马鱼意识到自己一事无成时,就会更加努力地游动,星形胶质细胞的活动也随之增强;当星形胶质细胞的活动达到阈值时,这些细胞就会向斑马鱼体内的神经元发出停止游泳的信号。他们当时还发现,神经元通过释放一种名为去甲肾上腺素的神经递质来向星状胶质细胞发出信号,从而增强其活动,这种神经递质会触发星状胶质细胞内部积聚钙离子。但他们不知道星形胶质细胞如何向神经元传递信息,使斑马鱼停止游动。
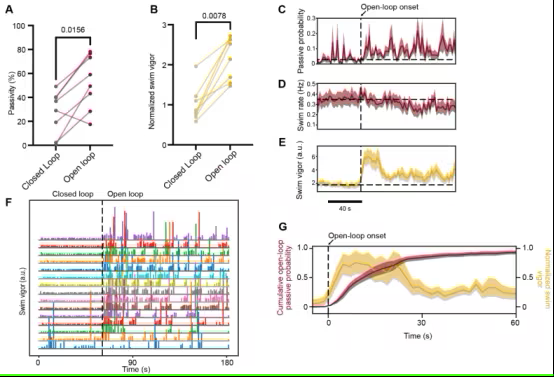
在这项新的研究中,研究人员使用了多种传感器来了解星形胶质细胞被激活时会释放出哪些分子。他们发现,当星形胶质细胞中的钙离子升高时,ATP会被释放到细胞之间的胞外空间。此外,他们还发现是星形胶质细胞而不是神经元释放了ATP。
众所周知,ATP 是一种载能分子,可为细胞内的几乎所有过程提供能量,但它也可以通过不同类型的受体作为神经元的一种信号传导分子。然而,当研究人员阻断这些 ATP 受体时,他们并没有发现斑马鱼的行为有任何变化。
这表明星形胶质细胞释放的 ATP 并没有直接作用于神经元,而是被分解了。之前的研究已表明,当 ATP 在细胞外释放时,酶会将其转化为腺苷,而腺苷也是大脑中一种已知的神经调节剂。
研究人员发现,当他们阻断神经元上的腺苷受体时,这种放弃行为就会受到抑制。这表明一种细胞外通路将 ATP 分解为腺苷,腺苷激活神经元上的受体,导致斑马鱼放弃并停止游泳。
Chen说,“这让我很惊讶,因为这似乎是一种间接的通路。首先,一种非神经元细胞参与其中,其次,有这种生化回路而不是某种神经元回路来实现这种行为。”
研究人员认为,与神经回路的快速时间尺度相比,这种生化回路可以在较慢的时间尺度上进行调节。他们还推测,分解 ATP 的酶可能在信号传输中发挥重要作用--有可能成为另一种治疗靶点。
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




