这项研究的一个关键发现是,小鼠三毛滴虫(Tritrichomonas musculis,简称T.mu)驱动的肺部免疫变化加剧了过敏性哮喘引起的气道炎症,但似乎对呼吸道感染有保护作用。
在一项新的研究中,来自多伦多大学的研究人员发现了肠道和肺部之间的一种新的通信途径。他们的发现突显了肠道微生物组中一个鲜为人知的成员如何重塑肺部免疫环境,从而对呼吸系统健康产生有益和有害的影响。相关研究结果于2024年12月19日在线发表在Cell期刊上,论文标题为“A gut commensal protozoan determines respiratory disease outcomes by shaping pulmonary immunity”。

论文通讯作者、多伦多大学特默蒂医学院免疫学副教授Arthur Mortha说,“生活在我们肠道内的和平肠道微生物是控制我们免疫系统的重要因素。越来越多的证据表明,这些共生微生物会影响其他器官,比如肺部、大脑、皮肤或关节。”
在过去的几十年里,肠道微生物群落组成的变化与一系列特征和包括肥胖、过敏、癌症和精神健康障碍在内的疾病有关。然而,这些研究主要集中在细菌上,毕竟细菌是肠道群落中发现的微生物中最大的一部分。
在这项新的研究中,Mortha和他的同事们专注于一种名为原生动物(protozoa)的不同类别的微生物。这些微生物也像细菌一样是单细胞的,但体积要大得多,身体也更复杂。虽然大多数已知的原生动物被归类为寄生虫,但一些鲜为人知的原生动物物种可以与它们的动物宿主共生。
Mortha说,“我们的目的是了解肠道中的共生原生动物物种如何影响疾病的结果和我们的整体健康。”
在这项研究中,这些作者研究了一种名为小鼠三毛滴虫(Tritrichomonas musculis,简称T.mu)的原生动物,它无害地存在于小鼠的肠道中。他们发现在T.mu定植的小鼠中,它们的肺部具有出乎意料的高水平特异性免疫细胞。重要的是,他们指出其中的一些免疫细胞起源于肠道并转移到肺部,在那里它们微调了局部免疫环境,并改变了与呼吸道疾病和感染相关的结果。
Mortha说,通过触发这些免疫细胞在肠道中产生和从肠道迁移到肺部,T.mu起着“肠道中的指挥员作用,协调免疫系统填充到身体的其他区域”。
这项研究的一个关键发现是,T.mu驱动的肺部免疫变化加剧了过敏性哮喘引起的气道炎症,但似乎对呼吸道感染有保护作用。
这些作者在多伦多高防范设施研究了改变的免疫环境对结核病的影响。他们发现,在T.mu定植的小鼠的肺部,较高水平的免疫细胞在气道中起到了抗菌屏障的作用,有助于控制结核菌感染并延缓其扩散到其他器官。
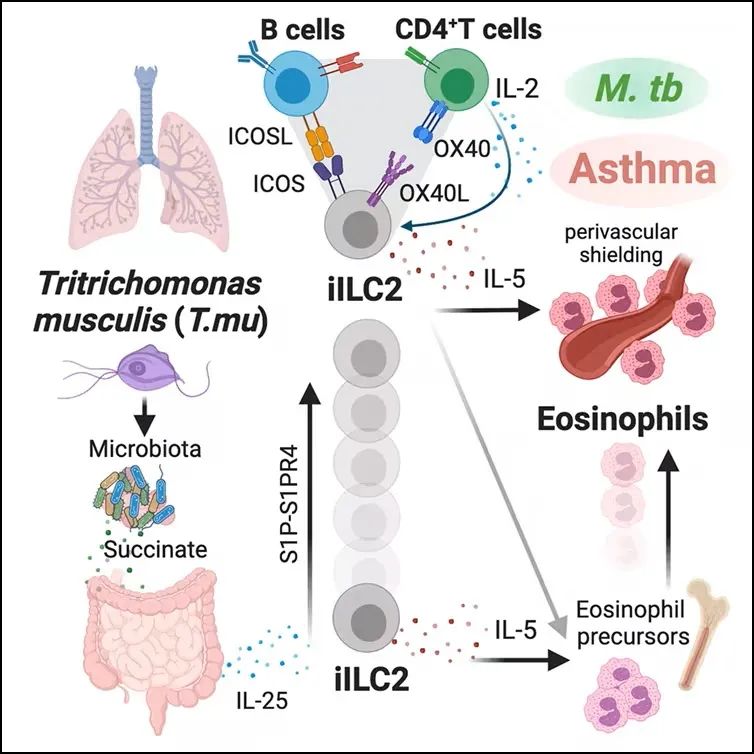
Mortha指出,这些结果与他的团队之前观察到的T.mu对小鼠肠道健康不同方面的相反影响是一致的。他说,“这种原生动物对肠道中的免疫系统有很强的影响。它加剧了结直肠癌产生和炎症性肠病,但也使宿主有能力承受非常严重的感染。”
这些作者还分析了严重哮喘患者的痰液样本。他们寻找与人类相关的原生动物的遗传特征,并在严重哮喘患者的样本中发现了比非哮喘炎症性肺病患者更高的信号,这表明他们在小鼠中的观察结果也可能与患者有关。
Mortha认为,这些发现为哮喘和潜在的其他慢性炎症性疾病的新诊断和治疗方法打开了大门。例如,特定原生动物的存在可能用于预测患者是否会患上严重哮喘,并可根据原生动物激活的免疫途径告知哪些药物最适合患者。他问道,“我们能否通过不局限于肺部而是针对肠道的治疗来预防或减缓哮喘的发展呢?”
除了肺部,这些作者如今正将注意力转向其他可能也受肠道微生物组调节的器官,并追踪免疫细胞从肠道到这些器官的旅程。
Mortha说,“免疫细胞从一个器官迁移到另一个器官,代表了器官之间相互通信的一种新方式,尤其是通过肠道中的微生物。它改变了我们感知与微生物组关系的方式,并表明我们不仅应该关注细菌,还应该关注原生动物和其他被忽视的微生物,以进一步了解健康和疾病。”







 京公网安备 11011402010692号
京公网安备 11011402010692号




