研究结果表明,一种特定的酶——一种名为CU43的内糖苷酶,对治疗那些由过度活跃的抗体引起的疾病特别有效。
重症肌无力(myasthenia gravis, MG)是一种慢性自身免疫疾病,在这种疾病中,抗体会阻碍神经和肌肉之间的交流,导致骨骼肌无力。它可导致复视、吞咽困难,偶尔还会出现严重的呼吸困难等症状。
许多自身免疫性疾病(比如 MG)以及一系列其他人类疾病都是由于无法调节 IgG 抗体的活性所致,这些疾病统称为 IgG 媒介病症(IgG-mediated pathology)。

在一项新的研究中,来自埃默里大学的研究人员发现了一个酶家族,它们能在诸如MG之类的疾病中减少IgG 媒介病症。这些涉及小鼠模型的研究结果表明,一种特定的酶——一种名为CU43的内糖苷酶,对治疗那些由过度活跃的抗体引起的疾病特别有效。相关研究结果于2024年10月21日在线发表在Cell期刊上,论文标题为“Potent efficacy of an IgG-specific endoglycosidase against IgG-mediated pathologies”。
论文共同通讯作者、埃默里大学医学院生物化学研究员Eric Sundberg说,“人类抗体虽然在对病原体做出免疫反应和对抗疾病方面至关重要,但有时也会引发疾病,包括自身免疫疾病。我们发现的酶可以改变抗体,使其不再致病。”
更有效的治疗方案
这种新发现的酶(CU43)被用来治疗小鼠体内多种不同的IgG 媒介病症,结果表明这种酶非常有效。
与目前市场上治疗MG的药物相比,这种新发现的酶在减轻症状方面更为有效,而且剂量更低---产生相同的生物效应所需的酶量要少1000倍。对患者来说,更有效、更低的剂量意味着更少的副作用和不同的用药选择。
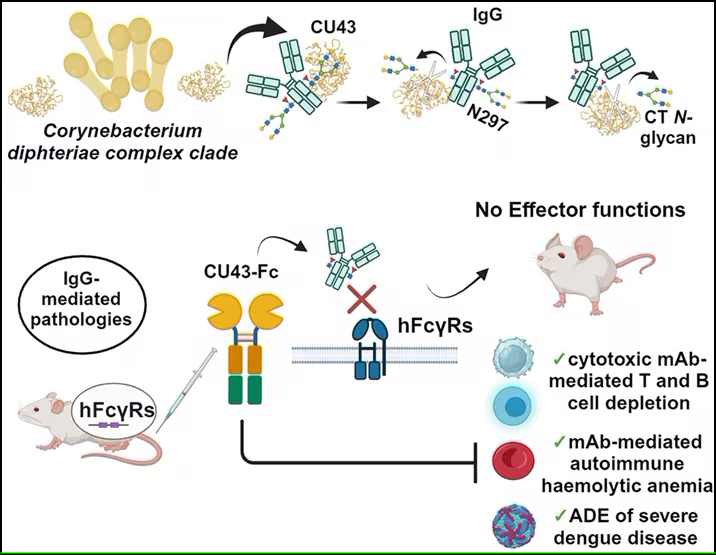
一种IgG特异性内糖苷酶对 IgG 媒介病症的有效作用
埃默里大学免疫学者Jeffrey Ravetch博士说,“与目前治疗自身免疫疾病的方法相比,这种酶的效力非常显著,因此值得考虑进一步开发用于治疗这类重要疾病。”
Sundberg说,“我们希望利用这些在小鼠身上取得的有希望的结果,将这种酶迅速推向人体临床试验。它有可能被用于治疗多种自身免疫疾病和其他IgG 媒介病症。”



文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




