威廉姆斯-伯伦综合征(Williams-Beuren syndrome, WBS)是一种罕见的疾病,会导致神经认知和发育方面的缺陷。然而,音乐和听觉能力在WBS患者身上得到了保留,甚至增强。在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员在这种疾病的模型中发现了这种能力的机制。相关研究结果于2022年9月23日在线发表在Cell期刊上,论文标题为“Innate frequency-discrimination hyperacuity in Williams-Beuren syndrome mice”。

了解是什么导致了WBS患者的卓越听觉能力,除了帮助推进对声音分辨能力的研究外,还可能为治疗该疾病提供一种靶标。WBS提供了对增强听觉能力的机制的深入了解。例如,一些WBS患者拥有完美的音调,也就是在没有参考指南的情况下区分音符或音频的能力。
论文通讯作者、圣犹大儿童研究医院发育神经生物学系的Stanislav Zakharenko博士说,“WBS之所以在神经发育障碍中更为人所关注,是因为患有这种疾病的儿童,尽管有严重的学习障碍,但与普通人群中的儿童相比,他们中有更多的人具有优越的音乐和语言能力。我们对此很感兴趣,想知道更多关于一种由27个基因缺失引起的疾病如何可能帮助患者获得比正常人更好的听觉处理能力。”
听觉皮层中兴奋的神经元
WBS的小鼠模型对声音频率的辨别能力增强。这些小鼠在听觉皮层中的频率编码也有改善,听觉皮层是大脑中处理声音的部分。这些作者发现,辨别声音频率的能力增强是由听觉皮层中过度兴奋的中间神经元引起的。
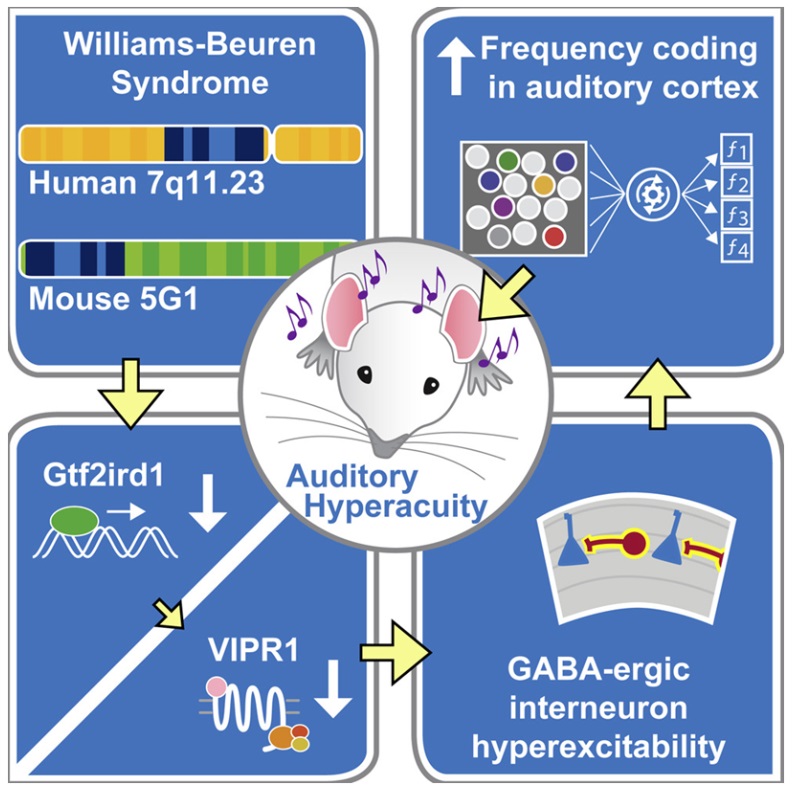
为了了解WBS患者听觉能力增强的细胞生物学基础,这些作者进行了RNA测序(RNAseq)实验。这些数据使得他们发现了一种叫做VIPR1的神经肽受体,它在WBS患者的听觉皮层中的表达减少了。在大脑类器官中也发现了VIPR1的减少,其中大脑类器官是实验室中使用人类诱导性多能干细胞构建出的高级模型。
这些作者发现,转录因子Gtf2ird1(由WBS患者丢失的27个基因之一编码)调节着VIPR1。在听觉皮层中剔除或过度表达VIPR1可以模拟或逆转WBS中观察到的听觉效果。因此,正是Gtf2ird1下调了VIPR1,导致了WBS对听觉能力的影响。
论文第一作者、圣犹大儿童研究医院发育神经生物学系的Christopher Davenport说,“在我们的数据中出现之前,我对VIPR1了解不多,因为与其他神经调节剂或神经递质受体相比,这个受体家族在大脑中的作用没有得到重视。我们的研究结果表明,它们可以强烈地影响信息处理和行为,并且很可能也与其他行为和疾病有关。”
Zakharenko说,“这项新的研究表明,减少神经元过度兴奋可能是通过靶向VIPR1治疗WBS的一种普遍机制。它还为研究音乐性和我们的大脑如何根据WBS模型的这些发现区分声音开辟了新的方向。
自然杀伤细胞(NK细胞)近来已成为开发新的免疫疗法的一个研究热点。人们对利用NK细胞进行癌症免疫治疗的兴趣正在迅速增长。然而,在大多数试验中,基于NK细胞的免疫疗法的疗效仍然有限。因此非常需要增强NK细胞的杀伤力的策略。
在一项新的研究中,来自美国丹娜法伯癌症研究院和哈佛医学院的研究人员报告了一种潜在的新方法来提高NK细胞疗法的疗效。相关研究结果近期发表在Cell期刊上,论文标题为“Augmenting NK cell-based immunotherapy by targeting mitochondrial apoptosis”。论文通讯作者为Anthony Letai和Rongqing Pan。

这些作者描述的这种新策略建立在他们发现NK细胞诱导的癌细胞凋亡是通过一种涉及线粒体的信号通路发生的。他们发现线粒体凋亡(mitochondrial apoptosis, mtApoptosis)途径对于有效的NK细胞杀伤是必不可少的,特别是处于生理上相关的效应细胞与目标细胞的比例下。这种线粒体凋亡机制取决于线粒体中促凋亡蛋白(pro-apoptotic protein)和抗凋亡蛋白(anti-apoptotic protein)的平衡。细胞是否自我毁灭取决于这种平衡的倾斜程度。他们表明,NK细胞的靶向作用使这种平衡倾向于促凋亡蛋白,因而为癌细胞经历线粒体凋亡做好了准备。
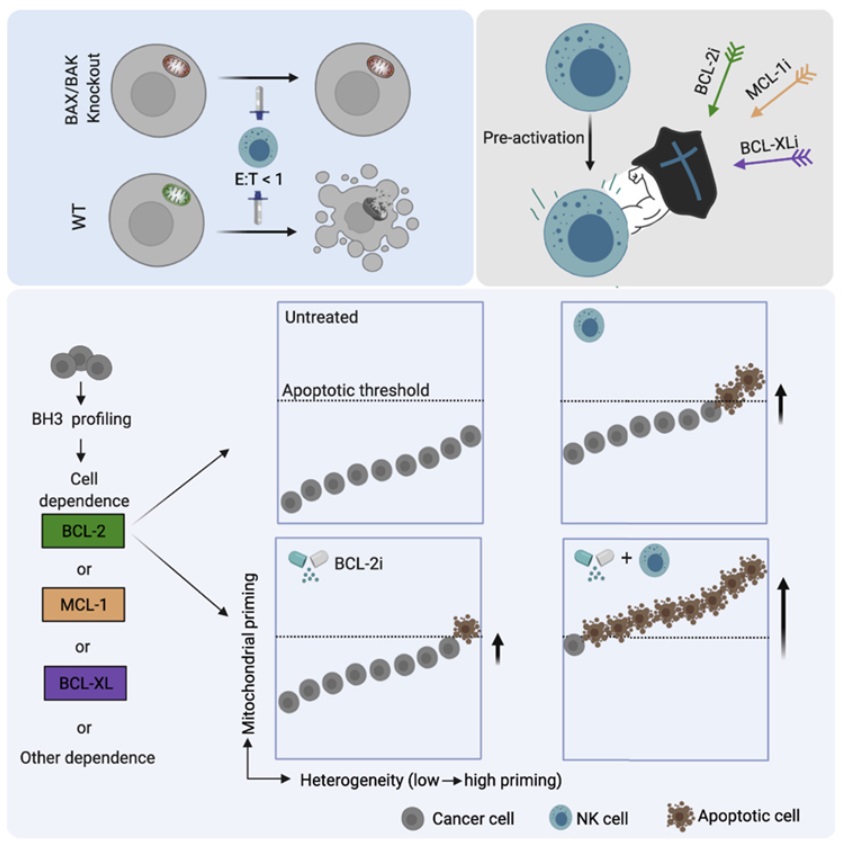
将NK细胞与一类将这种平衡进一步推向促凋亡蛋白的药物---BH3模拟物(BH3 mimetics)---相结合可协同杀死体外培养的癌细胞,并抑制癌症小鼠模型中的肿瘤生长。他们还发现,Letai实验室开发的一种筛选药物的方法---BH3图谱分析(BH3 profiling),可以用来确定最有可能增强NK细胞对特定癌症的杀伤力的BH3模拟药物。
综上所述,这些作者报告了一种合理和精确的策略来增强基于NK细胞的免疫疗法,这可能也适用于基于T细胞的免疫疗法。
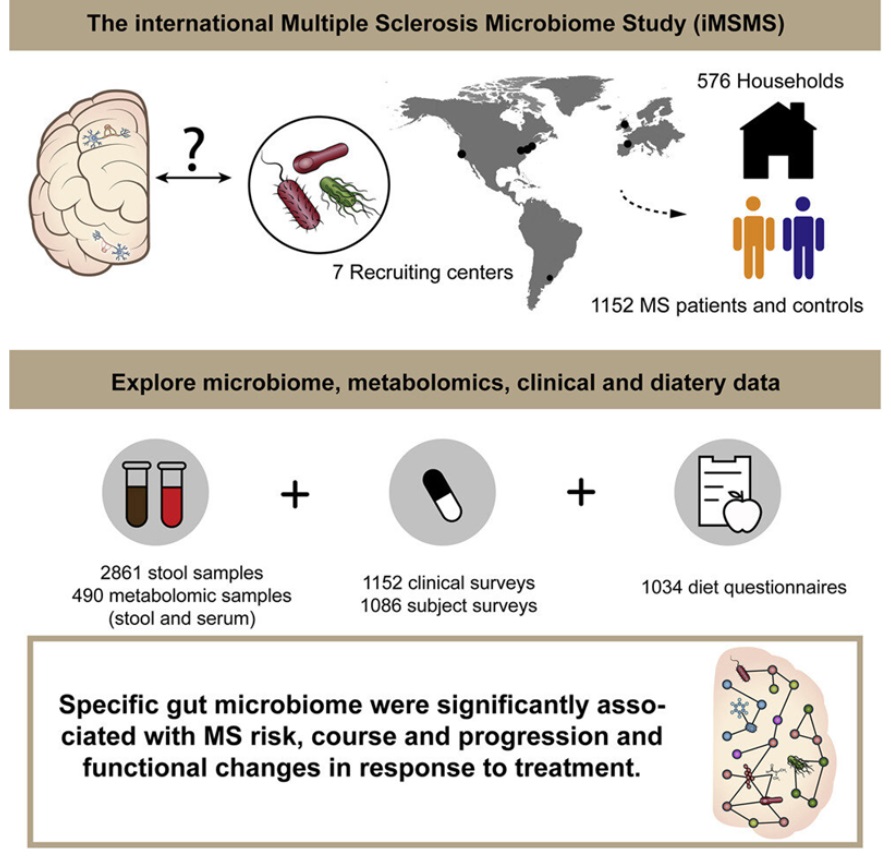
在一项新的研究中,来自iMSMS(International Multiple Sclerosis Microbiome Study, 国际多发性硬化症微生物组研究)联盟的研究人员发现多发性硬化症(MS)患者和健康人的肠道细菌图谱之间存在显著差异,接受不同药物治疗的MS患者之间也存在差异。虽然这些变化中的一些以前就有报道,但大多数是首次报道。他们还发现了这些细菌可能潜在影响疾病产生和治疗反应的新机制。相关研究结果发表在2022年9月15日的Cell期刊上,论文标题为“Gut microbiome of multiple sclerosis patients and paired household healthy controls reveal associations with disease risk and course”。

近年来,科学家们越来越多地将肠道细菌与包括糖尿病和关节炎在内的一些疾病---不仅仅是肠道疾病---联系在一起。随着2010年代初DNA测序技术的进步,微生物组研究领域真正打开了局面,使科学家们能够详细了解粪便、血液、粘膜组织和皮肤样本中存在哪些细菌。
直到最近,大多数表明肠道细菌和MS之间存在联系的实验证据都来自于对小鼠的研究。对人类的研究提供了不一致的结果---部分原因是参与者的数量较少,以及未能筛选出环境对个人微生物组的影响。一个人住在哪里---农村或城市,在山顶或在炼油厂旁边---对我们身体容纳的细菌起着很大的作用。
为了克服这些限制,参与IMSMS联盟的研究人员从三大洲招募了大量的多发性硬化症患者,并从与患者相同的家庭中选择了基因不相关的对照者。这是第一次在如此大规模的研究中使用这种方法。
这项新的研究描述了美国、英国、西班牙和阿根廷的576名患者和同等数量的家庭对照者之间的肠道微生物组谱差异。这些发现可能会带来新的治疗方法,涉及操纵微生物组或饮食干预。
美国加州大学旧金山分校威尔神经科学研究所成员Sergio Baranzini博士说,“这是一项参考研究,将在未来几年被该领域使用。”
通过他们的创新方案,Baranzini和他的同事们能够确定几十个与MS有关的新细菌物种,并确认了以前只与该疾病有关的其他物种。Baranzini说,“通过与对照者相比,我们对MS中存在不同的物种数量感到惊讶。”他们还发现,细菌物种的最大变化来源与参与者的地理位置有关,这证实了位置和当地饮食变化对肠道微生物组的重要性。第二大变异来源是参与者的疾病状况,这也是他们所预期的。
这项新的研究是iMSMS联盟正在进行的一系列研究中的第二项研究。iMSMS联盟是一个成立于2015年的国际联盟,目的是确定肠道细菌在MS疾病易感性、进展和对治疗的反应中的作用。第一项研究验证了家庭控制方案,表明它增加了基于人群的微生物组研究的统计能力。
Baranzini承认,这项新研究的结果主要是描述性的。他说,“在研究微生物组时,通常有两个问题被问及。第一个问题是‘谁在那里?’这就是我们在这篇论文中试图回答的问题。第二个是,‘它们在做什么?’”
回答第二个问题需要对单个细菌进行机理研究以了解它们的代谢情况。尽管如此,这些作者还是通过研究这些细菌编码的潜在途径,对他们发现的细菌正在做什么得到了一些提示。
Baranzini说,“知道了我们能够在病例和对照组中识别来自哪个细菌物种的基因,我们如今可以开始重建哪些潜在的途径在患者和对照组中是活跃的。”
比如,这些作者发现的一些与MS有关的细菌似乎在帮助人类处理来自植物的纤维方面发挥了作用,这些纤维副产物的浓度往往在MS患者身上增加了。其他细菌物种似乎对炎症和细胞的能量产生机制有影响。
这些作者还发现,接受一种称为干扰素β-1a的免疫调节剂治疗---最古老的MS疗法---的患者,他们的粪便中短链脂肪酸的浓度较低,而血液中的短链脂肪酸浓度较高。短链脂肪酸因其抗炎特性而闻名,因此这表明干扰素通过增加这些分子从肠道到血流的运输而发挥作用,Baranzini说,这可能是干扰素的作用机制之一。
iMSMS联盟将继续招募患者,扩大到德国和加拿大,直到队列中的参与者总数达到2000人。从今年秋天开始,他们还将对一部分患者进行为期两年的跟踪调查,以了解他们的肠道菌群在应对治疗、生活方式改变和疾病进展方面的变化。这些研究的所有数据都将公开提供。
Baranzini补充说,“这是一个例子,说明了只有合作才能实现大科学。在iMSMS联盟中,我们真正汇集了微生物组研究领域和MS领域最好和最聪明的研究人员,他们都在为同一个目标而努力。”
作为一种罕见的遗传性疾病,胱氨酸病(cystinosis)是由一个编码胱氨酸转运蛋白(cystinosin)的基因发生突变引起的。在一项新的研究中,来自美国加州大学圣克鲁斯分校、斯坦福大学和德克萨斯大学西南医学中心的研究人员结合了他们在研究蛋白结构和功能的三种专门方法--- X射线晶体学、低温电镜(cryo-EM)和双电子-电子共振(double electron-electron resonance, DEER)---方面的专业知识,确定了这种突变如何干扰胱氨酸转运蛋白的正常功能,提出了一种开发这种疾病新疗法的方法。相关研究结果于2022年9月15日在线发表在Cell期刊上,论文标题为“Structure and mechanism of human cystine exporter cystinosin”。

论文共同通讯作者、加州大学圣克鲁斯分校化学与生物化学系主任Glenn Millhauser说,“这篇论文为如何将这三个领域与生化检测结合起来,快速缩小蛋白功能的范围并确定治疗策略树立一个典范。”
胱氨酸转运蛋白是一种专门的转运蛋白,在细胞如何控制必需的氨基酸半胱氨酸方面起着关键作用。细胞不断地回收蛋白,将它们分解成氨基酸,用于构建新的蛋白。像胱氨酸转运蛋白这样的转运蛋白将氨基酸从溶酶体---一种分解蛋白的细胞区室---转移到细胞中,以便重新使用。当胱氨酸转运蛋白突变而不能正常运作时,一种形式的半胱氨酸(一种称为胱氨酸的二聚体)就会在溶酶体内积累。胱氨酸(cystine)的异常积累对组织和器官造成广泛的损害,并可能导致肾脏衰竭、肌肉萎缩和其他问题。
Millhauser说,“这是一种罕见的疾病,但它可能是致命的。如果不加以治疗,胱氨酸酶病患者通常在10岁前死亡。”
胱氨酸转运蛋白在向溶酶体内部开放以装载胱氨酸和向外部开放以释放胱氨酸时,会采取不同的构象。斯坦福大学(由Liang Feng教授领导)和德克萨斯大学西南医学中心(由Xiaochun Li教授领导)的研究团队利用X射线晶体学和低温电镜解决了胱氨酸转运蛋白在这些不同结构构象中的结构。
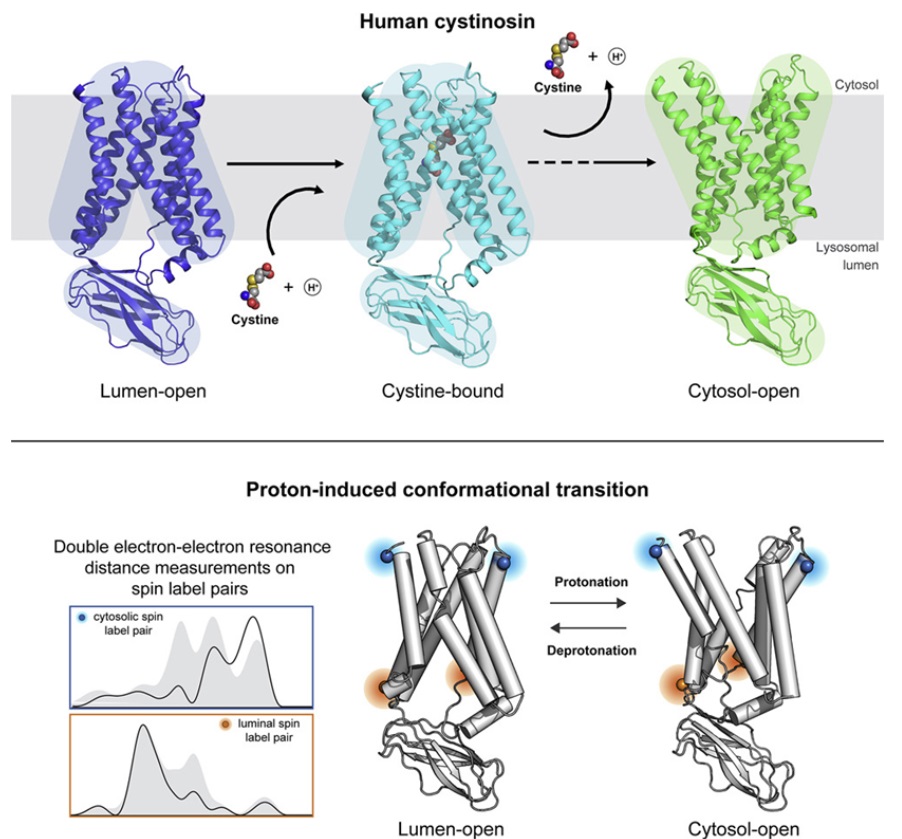
然而,了解胱氨酸转运蛋白在转运过程中的结构变化,需要Millhauser实验室进行DEER研究。DEER是一种专门的磁共振技术,可用于确定蛋白如何改变它的形状。
Millhauser说,“有了这种技术,我们就能够弄清楚让胱氨酸转运蛋白在这些不同的状态之间切换的机制,我们可以缩小范围,确定这种蛋白的哪些氨基酸在驱动这种转变。如今我们可以看到这些突变是如何改变这种蛋白改变形状和将胱氨酸泵出溶酶体的能力。”
对胱氨酸转运蛋白转运活性的分子机制的这些新见解,不仅提供了对胱氨酸病发病机制的更详细的理解,而且还提出了一种可能的治疗这种疾病的策略。这些作者写道,“通过开发有利于细胞质开放构象的构象选择性小分子或生物制剂,可能会增强胱氨酸转运蛋白的转运活性。”类似的方法可用于靶向其他转运蛋白,这些转运蛋白与一系列疾病相关。
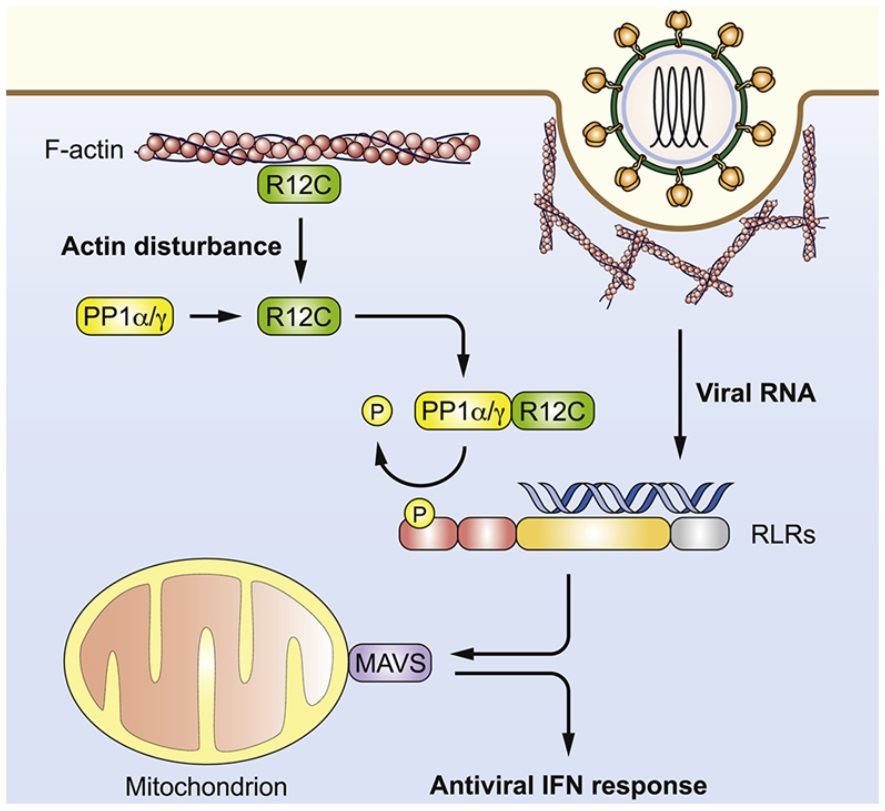
在一项新的研究中,来自美国克利夫兰诊所的研究人员发现一种称为肌动蛋白细胞骨架(actin cytoskeleton)的细胞结构的破坏是身体对病毒感染做出反应的“启动信号(priming signal)”。这一结果可能为开发新的抗病毒疫苗和治疗方法奠定了基础。相关研究结果发表在2022年9月15日的Cell期刊上,论文标题为“Actin cytoskeleton remodeling primes RIG-I-like receptor activation”。

在此之前,病毒的遗传物质(比如RNA)被认为是生活在细胞中的某些传感分子触发免疫反应的唯一条件:对许多类型的细胞来说,这是一种“警报系统”。通过训练患者的免疫系统来识别病毒,RNA也可以作为开发疫苗的基础。这项新研究显示这种信号传递过程还需要破坏细胞内的肌动蛋白细胞骨架,在病毒感染细胞时这种破坏就会发生。
论文共同通讯作者、克利夫兰诊所佛罗里达研究与创新中心科学主任Michaela Gack博士说,“这是考虑免疫系统如何被激活的一个基本的新方法,其意义在于这可能导致广泛的抗病毒疗法。我们的数据显示,这一过程在不同类型的RNA病毒中是常见的。 ”
这些作者指出肌动蛋白细胞骨架的扰乱促进了RIG-I样受体(RLR)的激活。由病毒感染或常用试剂诱导的肌动蛋白细胞骨架重排,触发了PPP1R12C---蛋白磷酸酶-1(protein phosphatase-1, PP1)的一个调节亚基---从丝状肌动蛋白重新定位到细胞质中的RLR。这触发去磷酸化介导的RLR启动,并与RNA激动剂一起诱导有效的RLR下游信号传导。剔除PPP1R12C基因会损害抗病毒反应,并增强对包括SARS-CoV-2、流感病毒、小RNA病毒(picornavirus)和水泡性口炎病毒(VSV)在内的几种RNA病毒感染的易感性。这些结果确定了肌动蛋白细胞骨架扰乱是RLR介导的先天免疫的启动信号,这可能为开发抗病毒试剂或佐剂设计开辟了新途径。
由肌动蛋白组成的细胞骨架不仅是细胞的结构支撑,而且也是在细胞生长、分裂和内化关键物质等过程中起着关键的作用。Gack博士说,病毒会破坏细胞骨架,但疫苗成分和某些治疗药物也可做到这一点。
Gack博士说,“这一过程是否被我们的细胞免疫监视系统感知并能触发抗病毒反应一直是个未知数。我们的研究表明,特定的免疫受体感知由病毒诱导的肌动蛋白细胞骨架重排,然后触发警报。”
尽管已经存在了几十年,但是在COVID-19大流行期间,人们对使用RNA作为疫苗和治疗方法的基础的兴趣成倍增长。这项新的研究表明这种触发系统在多种病毒中是相似的,包括寨卡病毒、流感病毒或SARS-CoV-2,即引起COVID-19的冠状病毒。
Gack博士及其研究团队还发现脂质成分或病毒样颗粒,比如那些用于疫苗或基于RNA的治疗药物中的脂质成分或病毒样颗粒,可以引起促使免疫反应所必需的细胞骨架破坏。这些结果可能有助于开发者“微调”治疗剂或疫苗的免疫刺激效力。
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




