慢性炎症是对刺激剂、损伤或失调性急性炎症的长期炎症反应。慢性低度炎症与许多复杂疾病有关,包括癌症、心血管疾病(CVD)、呼吸系统疾病,自身免疫性疾病和内分泌代谢疾病。然而,将慢性低度炎症与慢性疾病联系起来的潜在分子途径知之甚少。C-反应蛋白(CRP),一种主要由肝脏产生的急性期蛋白,已被确定为全身炎症的标志物。环境和遗传因素对血清 CRP水平有重大影响。在前期的遗传关联研究中,已经确定了58个独特的位点,使用来自约200,000名欧洲人的数据,解释了约7%的CRP水平变异。尽管如此,这种复杂特征的遗传结构仍没有得到很好的表征。近日,来自英国伦敦帝国理工学院的研究学者在Nat Commun上发表了一篇题为“Genetic analysis of over half a million people characterises C-reactive protein loci”的研究论文,解开了循环CRP水平的潜在遗传成分可以阐明CRP参与疾病过程的机制,发现了调节炎症的潜在治疗靶点。
在该研究中,研究人员报告了关于CRP水平的最大的全基因组关联研究(GWAS),使用的数据来自英国生物库(UKB)和基因组流行病学中的心脏和衰老研究队列(CHARGE)联盟。此外,他们进行了一系列GWAS后的分析,以阐明研究结果的功能特点,并突出潜在途径。最后,他们进行了全表型关联研究(PheWAS),从宏观上研究慢性炎症的临床后果,并辅以孟德尔随机化(MR)分析来评估因果关系。
通过对英国生物样本库参与者(N = 427,367,欧洲血统)和基因组流行病学(CHARGE)联盟(总N = 575,531欧洲血统)中关于全身炎症标志物C反应蛋白(CRP)的最大全基因组关联研究(GWAS),他们确定了266个独立位点,其中211个以前没有被报道过。基因集分析突出了42个与CRP水平相关的基因集(p ≤ 3.2×10−6)和组织表达分析表明CRP相关基因与肝脏和全血基因表达有很强的相关性。表型组范围关联研究确定了27项与遗传确定的CRP相关的临床结局,随后的孟德尔随机化分析结果支持与精神分裂症,慢性气道阻塞和前列腺癌的因果关系。
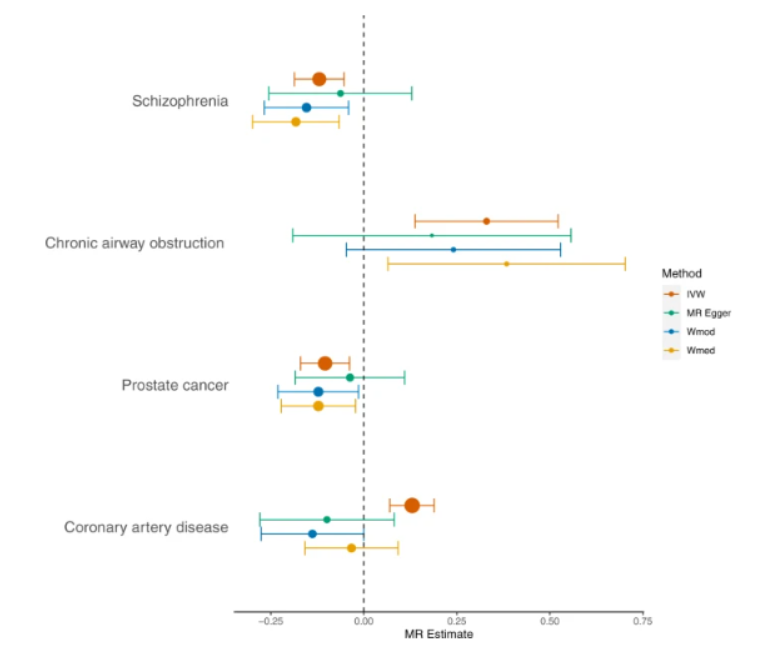
总之,该研究结果确定了慢性低度炎症的遗传位点和功能特性,并为与一系列疾病的因果关系提供了证据。
新研究表明化合物RP-6306有望治疗发生CNE1扩增的癌症
在一项新的临床前研究中,来自加拿大多伦多西奈山医院、多伦多大学和美国Repare Therapeutics公司的研究人员发现一种旨在阻断某些癌细胞生存所必需的PKMYT1激酶的新药物显示出遏制肿瘤生长的前景。相关研究结果发表在2022年4月28日的Nature期刊上,论文标题为“CCNE1 amplification is synthetic lethal with PKMYT1 kinase inhibition”。

这种称为RP-6306的新药物是多伦多西奈山医院卢恩菲尔德-塔伦鲍姆研究所(LTRI)高级研究员Daniel Durocher及其团队在进行基于CRISPR-Cas9基因编辑技术的合成致死性筛选过程中设计出来的。它是一种口服的生物可利用的选择性抑制剂,可选择性抑制PKMYT1。
这些作者确定了对发生CCNE1扩增的癌细胞的生存能力至关重要的基因。癌细胞发生CCNE1扩增是一些难以治疗的卵巢癌、子宫内膜癌和膀胱癌的典型特征。他们发现PKMYT1在发生CCNE1扩增的癌细胞中是必不可少的,但在其他的健康细胞中却不是如此。在与精准肿瘤学公司Repare Therapeutics的合作中,他们开发出一种名为RP-6306的药物,它能阻断PKMYT1的活性并有效地杀死发生CCNE1扩增的癌细胞。Durocher说,“这些癌细胞依赖PKMYT1生存。我们的临床前数据显示,药物RP-6306靶向这些类型的肿瘤并显著抑制肿瘤生长的能力显示出巨大的前景。”目前,发生CCNE1扩增的癌症很少有治疗选择。Repare Therapeutics公司的高级科学家David Gallo说,他们能够证实RP-6306既有效力又有选择性,可以在人体中口服使用。
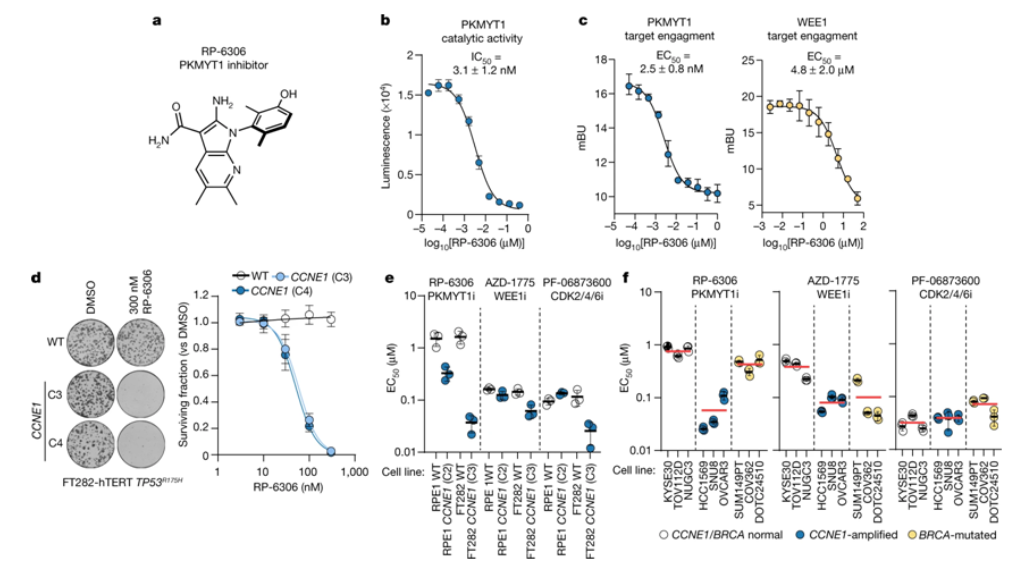
RP-6306是一种选择性PKMYT1抑制剂,在发生CCNE1扩增的癌细胞中具有活性
Gallo说,“众所周知,发生CCNE1扩增的妇科肿瘤和其他实体瘤对目前的标准治疗方法有抵抗性。现在迫切需要为这些患者找到新的治疗方案。”这项研究是Durocher实验室和Repare Therapeutics公司之间的紧密合作的结果。Durocher于2016年与Frank Sicheri一起创立了Repare Therapeutics公司。Durocher说,“我们的团队与Repare Therapeutics公司之间的这种紧密合作突出了工业界和学术界如何能够共同为癌症患者发现新的治疗方案。在启动一项临床试验的同时发布一种新的靶标是很罕见的。这充分说明了这种合作的创新能力。”Repare Therapeutics公司已在发生CCNE1扩增的实体瘤患者中启动了I期临床试验,预计将在2022年底获得初步结果。
揭示G蛋白偶联受体介导的β-arrestin激活机制
在美国食品药品管理局(FDA)批准的所有药物中,大约有三分之一的药物靶向一个大型的生物分子家族,即所谓的G蛋白偶联受体(GPCR),GPCR的职责是触发细胞对胞外刺激的反应。人体中存在800多种不同的GPCR,并在无数种疾病的病理和治疗中发挥作用,包括癌症、2型糖尿病、肥胖、睡眠障碍、精神分裂症和抑郁。如今,来自多个研究机构的研究人员对GPCR的作用机制有了新的认识,这是朝着开发具有较少副作用的改良药物迈出的一步。相关研究结果于2022年4月27日在线发表在Cell期刊上,论文标题为“GPCR-mediated β-arrestin activation deconvoluted with single-molecule precision”。

论文共同通讯作者、哥伦比亚大学瓦格洛斯医学院精神病学实验治疗学教授Jonathan A. Javitch博士说,“靶向GPCR的药物被用来治疗医学上的一系列疾病---心脏病、肺病、睡眠和神经精神疾病,而且GPCR也负责嗅觉、味觉和视觉。”
但像许多治疗方法一样,靶向GPCR的药物往往有副作用,其中的一些副作用可能是严重的。例如,靶向一组称为阿片受体(opioid receptor)的GPCR的药物对治疗疼痛非常有效,但也有危险的副作用,如呼吸困难和便秘。目前,这些化合物在靶向缓解疼痛的信号通路的同时也会激活呼吸道信号通路和肠道信号通路。论文共同第一作者、哥伦比亚大学精神病学系临床神经生物学助理教授Wesley B. Asher博士说,“在我们的研究中,我们使用的方法使我们能够以前所未有的细节探究药物刺激的GPCR如何激活蛋白β-arrestin,β-arrestin既参与终止一些信号,又参与调解其他信号。我们的最终目标是能够开发出信号通路特异性的化合物。”这项研究涉及使用一种称为单分子荧光共振能量转移(smFRET)成像的前沿技术。该技术由论文共同通讯作者、圣犹大儿童研究医院的Scott C. Blanchard博士推进,以无与伦比的细节捕捉单个蛋白系统内的运动。由于该方法能实时可视化观察单个蛋白的结构变化,它能提供将样本中大量蛋白平均化的传统方法无法获得的新见解。利用smFRET技术,这些作者决定探测β肾上腺素能受体---一种与生物学的许多不同领域广泛相关的典型GPCR。药物或内源性激素与细胞外膜上的β-肾上腺素能受体或其他GCPR结合,导致细胞内部出现信号,这些信号是由G蛋白的激活介导的。但是另一种类型的蛋白---β-arrestin---的结合终止了这种信号传导,并能激活其他想要或不想要的下游途径。通过观察β-arrestin被β肾上腺素能受体激活的过程,这些作者发现了关于β-arrestin如何与β肾上腺素能受体相互作用并被它激活的新细节,这些过程需要解除这两种蛋白的自我抑制。
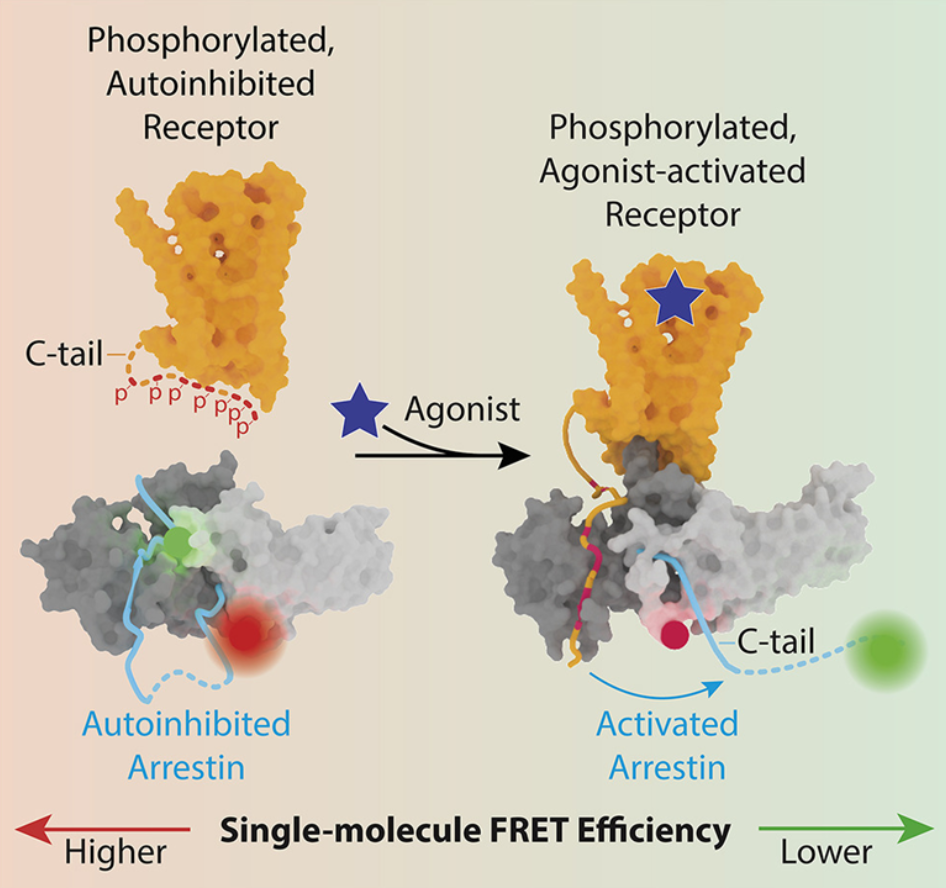
这些发现最终可能有助于确定改进的药物,以便它们通过调节β-arrestin与β肾上腺素能受体的结合和/或激活来影响特定途径而不是其他途径。
这些研究结果还支持“条形码假说(barcode hypothesis)”,即受体内不同的磷酸化模式或“条形码”可导致不同的β-arrestin激活模式,这反过来又决定了下游的信号传导结果。这些作者希望,更好地理解受体“条形码”和β-arrestin激活之间的关系,可以为如何靶向特定的下游途径而不是其他途径,提供重要的新见解。
重磅研究!开发出新型成像方法CATCH,可精确地在哺乳动物组织中鉴定药物结合的靶标
在一项新的研究中,来自斯克里普斯研究所的研究人员开发出一种可以在不同的组织中以比以往更高的精度对药物与身体中靶标结合的地方进行成像的方法。这种新方法可能成为药物开发的一个常规工具。相关研究结果于2022年4月27日在线发表在Cell期刊上,论文标题为“In situ identification of cellular drug targets in mammalian tissue”。
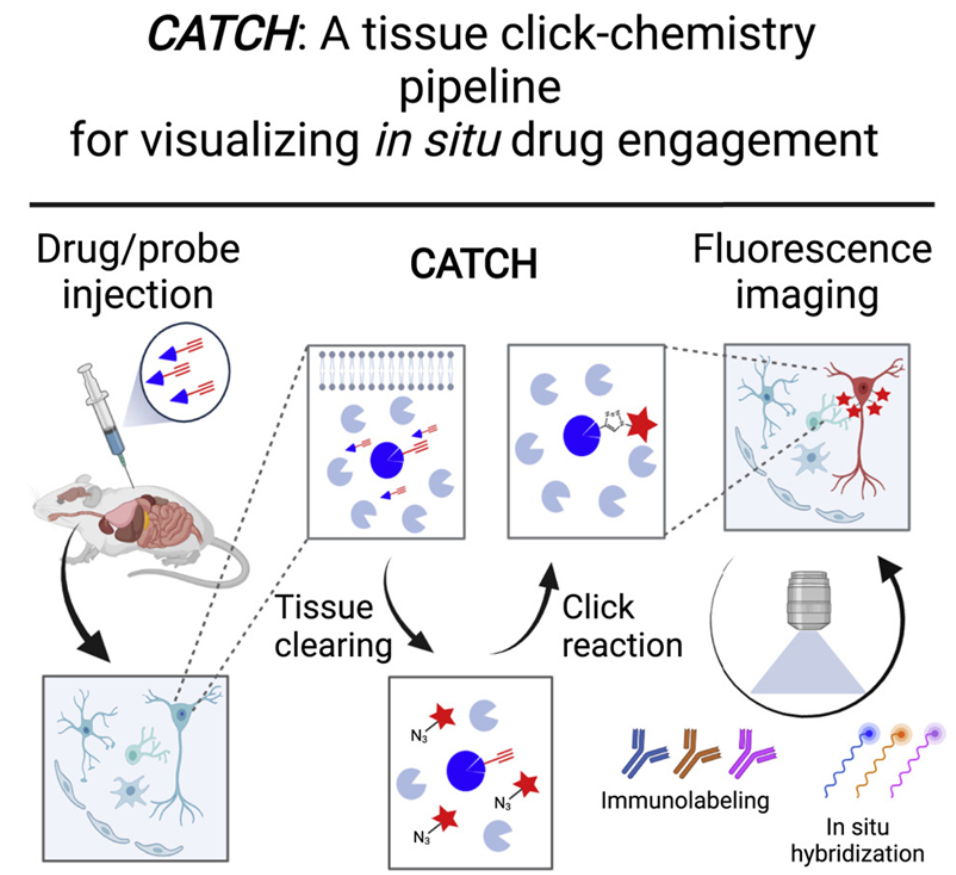
这项研究描述了这种名为透明辅助组织点击化学(clearing-assisted tissue click chemistry, CATCH)的新方法,它将荧光标签附着在药物分子上,并使用化学技术来改善荧光信号。这些作者利用几种不同的实验性药物展示了这种方法,揭示了这些药物分子靶向结合它们的靶标的位置,而且即便在单个细胞中,也是如此。
论文通讯作者、斯克里普斯研究所神经科学助理教授Li Ye博士说,“这种方法最终应该让我们第一次相对容易地看到为什么一种药物比另一种药物更有效,或者为什么一种药物有特定的副作用而另一种药物没有。”了解药物分子在哪里与它们的靶标结合以发挥它们的治疗效果和产生副作用,是药物开发的一个基本部分。然而,针对药物与靶标相互作用的研究传统上涉及相对不精确的方法,如对整个器官中的药物分子浓度进行批量分析。CATCH方法涉及将微小的化学手柄插入到药物分子中。这些独特的化学手柄不会与体内的其他东西发生反应,但允许在药物分子与靶标结合后添加荧光标签。这部分上是因为人类或动物组织倾向于扩散和阻挡来自这些荧光标签的荧光Ye和他的团队将这种标记过程与一种使组织相对透明的技术相结合。在这项初步研究中,这些作者针对“共价药物(covalent drug)”优化并评估了他们的方法,这些药物通过称为共价键的稳定化学键不可逆地与它们的靶标结合。这种不可逆的结合使得验证这类药物是否结合了它们的预期靶标变得尤为重要。这些作者首先评估了大脑中一种叫做脂肪酸酰胺水解酶(FAAH)的几种共价抑制剂。FAAH抑制剂具有提高包括“幸福分子”花生四烯酸乙醇胺(anandamide)在内的大麻素分子水平的作用,目前正在研究如何治疗疼痛和情绪失调。他们能够在单细胞水平上对这些抑制剂在大块小鼠脑组织中结合它们的靶标的位置进行成像,并能够轻松地区分它们的不同的靶标结合模式。
在一项实验中,他们发现一种在2016年法国的一项临床试验中造成了一人死亡和数人受伤的名为BIA-10-2474的实验性FAAH抑制剂,即使在小鼠缺乏FAAH的情形下,也会与小鼠大脑中的未知靶标结合,这就为这种抑制剂的毒性来源提供了线索。
在展示这种新方法前所未有的精确性和多功能性的其他测试中,这些作者证实他们可以将药物-靶标成像与单独的荧光标记方法相结合来揭示药物结合的细胞类型。他们还可以在神经元的不同部位区分药物-靶标的结合位点。最后,他们可以观察到适度不同剂量的药物往往会显著影响不同大脑区域中的靶标结合程度。Ye强调说,这项原则性研究只是一个开始。他和他的团队计划进一步开发CATCH,以用于更厚的组织样本,最终可能是整个小鼠。此外,他们还计划将这一基本方法扩展到更常见的、非共价结合的药物和化学探针。Ye说,总的来说,他设想这种新方法不仅是药物发现的基本工具,甚至是基础生物学的工具。
核靶向AIE光敏剂通过光动力及双酶抑制用于癌症治疗
三苯胺结构具有双光子特性,经过功能性修饰或金属配位可实现亚细胞器或生物分子靶向,在生物医药,分子探针等领域具有广阔的应用前景。中山大学化学学院毛宗万教授课题组从多维度对三苯胺骨架进行结构单元功能化,取得系统性研究成果。例如:开发了二价铂配位的三脚架型人端粒G-四链体DNA稳定剂,实现了端粒酶的高效抑制 (Nat. Commun., 2018, 9, 1-11); 设计了对G-四链体DNA荧光寿命选择性响应的三脚架阳离子探针,通过荧光寿命成像首次实现了正常细胞和癌细胞的可视化区分 (Angew. Chem. Int. Ed. 2020, 132, 9806-9813); 采用线粒体膜和mtDNA双色响应的三苯胺骨架探针,通过超分辨成像技术首次追踪并定义了细胞胀亡的精细过程 (Adv. Sci. 2021, 202004566)等。在此基础上,近日,毛宗万教授课题组联合新加坡国立大学刘斌教授共同开发了一种基于三苯胺结构的核靶向光敏剂(MeTPAE),MeTPAE不仅具有高效ROS产率,其优异的双光子吸收性质也为其双光子光动力治疗提供了便利。一方面,MeTPAE可以抑制核内组蛋白去乙酰化酶(HDACs)的活性。另一方面由于其AIE特性,MeTPAE与核酸结合可以产生强荧光,以及稳定的端粒G4DNA结合力。得益于其优异的ROS生成效率,MeTPAE可以有效地破坏核酸并抑制端粒酶活性。
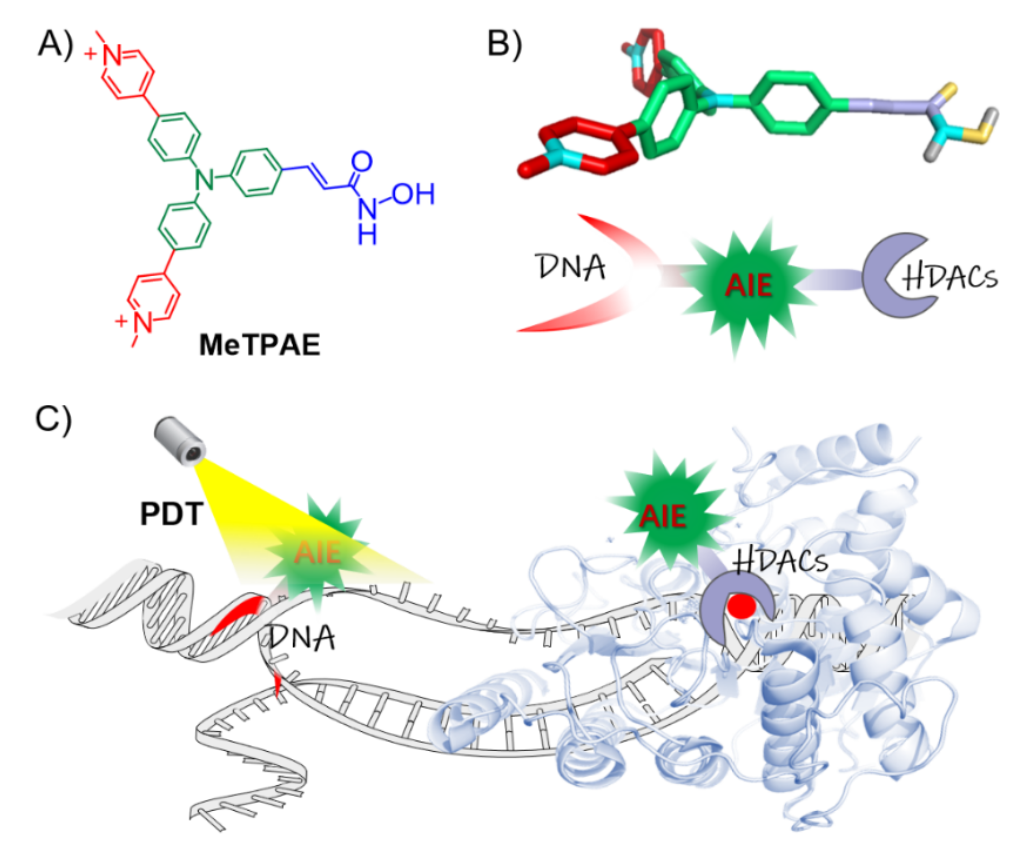
图注:A: MeTPAE的化学结构。B和C:MeTPAE 对核酸和组蛋白去乙酰酶(HDACs)的双重作用示意图。MeTPAE进入细胞核后,不仅可以与HDACs相互作用抑制细胞增殖,还可以通过PDT精确地破坏端粒和核酸。
实验发现,MeTPAE可以对DNA,尤其是端粒G4DNA表现出敏感的荧光响应。MeTPAE不仅是一种有效的光激活端粒酶抑制剂(有效抑制率EC50为 2.41 ± 0.10 μM);MeTPAE在光照条件下也具有有效的DNA切割活性。使用商业化检测试剂盒对分子的HDACs的抑制活性进行评价,结果发现MeTPAE具有与FDA批准的抑制剂(SAHA,romidepsin和panobinostat)相似的HDACs抑制活性,这为MeTPAE的抗肿瘤能力提供了基础。通过共聚焦成像的单/双光子通道可以同时检测到MeTPAE不断富集于细胞核,并可用于追踪细胞的有丝分裂过程。在黑暗条件下,相比于HeLa细胞,人的原代正常成纤维细胞具有更高的存活率;在光照条件下,MeTPAE可以通过光动力方式更显著地杀伤肿瘤细胞。该工作通过开发能够细胞核靶向的药物分子,并将分子单元官能化实现了单分子多途径 (肿瘤细胞端粒酶抑制,组蛋白去乙酰化抑制剂以及双光子光动力(PDT) )的癌症治疗,为恶性肿瘤的高效治疗提供了新途径。相关研究成果以“A Nuclear‐Targeted AIE Photosensitizer for Enzyme Inhibition and Photosensitization in Cancer Cell Ablation”为题发表在Angewandte Chemie International Edition,并被选作Hot Paper文章。毛宗万教授和新加坡国立大学刘斌教授为共同通讯作者,化学学院的博士毕业生王康男为第一作者,中山大学化学学院为本成果的第一通讯单位。该工作得到国家自然科学基金、中央高校基本科研业务费,生物无机与合成化学教育部重点实验室的大力支持。
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。
返回列表