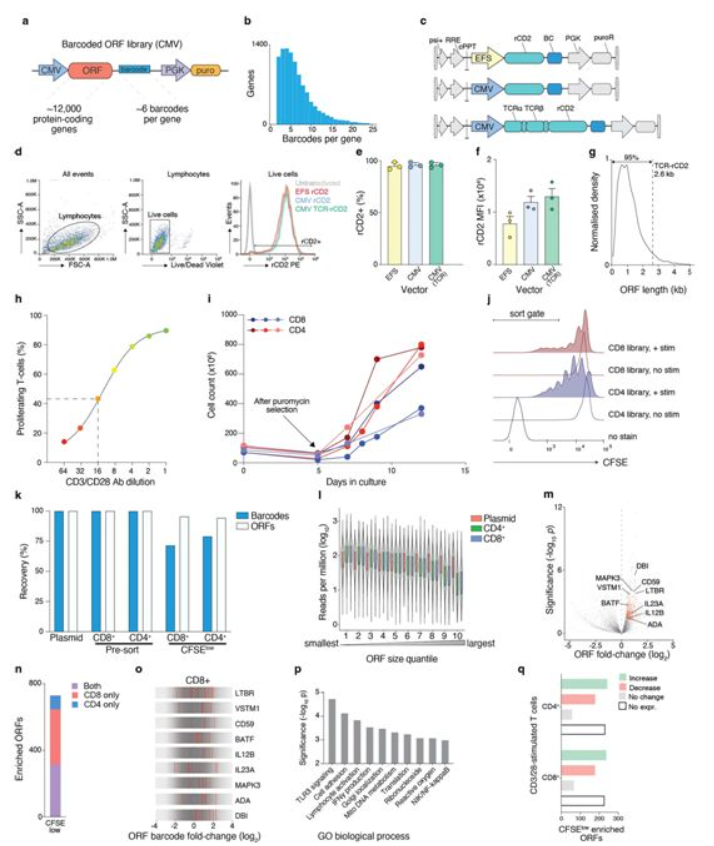
图为 在原代T细胞中进行人ORF文库筛选
论文第一作者、 Sanjana实验室博士后Mateusz Legut博士说,“我们的目标是采用现有的免疫疗法,并使它们变得更好。我们对LTBR如此明显地增强CAR疗法感到吃惊。这是朝着开发下一代CAR-T细胞疗法迈出的重要一步。”
这些作者发现,添加LTBR会重建T细胞的基因组,触发许多其他能增强T细胞功能的基因的表达。他们能够通过结合基因过表达筛选和单细胞基因组学迅速了解LTBR和类似修饰基因的影响。他们开发的新方法---OverCITE-seq---使得他们能够测试不同修饰基因对T细胞细胞状态的影响,其中包括每个基因的表达、装饰细胞表面的蛋白以及每个细胞表达的独特T细胞受体(克隆型)。OverCITE-seq让他们详细了解了每个修饰基因如何提高T细胞活性,并且在单细胞实验中对所有排名靠前的基因都是这样做的。对于LTBR来说,这产生了一个早期线索,即大量的基因正在发生变化,导致他们进一步确定了一个被充分研究的称为NF-kB的基因表达调节因子驱动许多这些变化。这种LTBR驱动的深度重编程也出现在所谓的非常规T细胞中,比如γδT细胞,它们的丰度比常规T细胞低,但可以靶向更多样化的肿瘤。
论文共同作者、纽约大学帕尔马特癌症中心临床淋巴瘤项目主任Catherine Diefenbach博士说,“最令人激动的是证实了LTBR和其他排名靠前的基因改善了CAR-T细胞和γδ T细胞的抗原特异性反应。如果在体外和临床测试中得到验证,这可能对在未来针对淋巴性恶性肿瘤和其他癌症的CAR-T细胞疗法产生深远的影响。”
这些作者还将几种排名靠前的修饰基因与类似于FDA批准的两种现有血癌疗法的CAR-T细胞相结合:tisagenlecleucel(Kymriah)和axicabtagene ciloleucel(Yescarta)。几乎所有测试的修饰基因都提高了CAR-T反应,包括LTBR。由于与来自健康供者的T细胞相比,来自癌症患者的T细胞往往状况不佳,他们还想测试LTBR使来自癌症患者的T细胞恢复活力的能力。他们将LTBR与CAR一起添加到被诊断为弥漫性大B细胞淋巴瘤(一种血癌)患者的功能失调的T细胞中,并发现T细胞功能得到了类似的提升,这表明该技术可以作为一种优化疗法在临床上发挥作用。
英国卡迪夫大学医学院T细胞与免疫疗法专家Andrew Sewell博士(未参与这项新的研究)指出,“T细胞的功能增益筛选具有巨大的潜力,可以发现如何使免疫疗法更加成功---特别是在目前CAR-T细胞疗法效果不佳的实体瘤中。”
这些作者还发现,用修饰基因增强的T细胞不仅能够更好地根除白血病,而且还能根除胰腺癌细胞。这些结果不仅对开发用于治疗血癌的增强型CAR-T疗法是令人鼓舞的,而且它们可能在靶向实体瘤方面发挥关键作用,毕竟在实体瘤治疗领域,建立高效的CAR-T细胞疗法一直是更具挑战性。
Sanjana实验室一直专注于开发新的基因编辑和功能基因组技术,以减少目前免疫疗法的高失败率并建立下一代疗法。鉴于像LTBR这样新表征的修饰基因可以与已经被批准上市的CAR-T细胞疗法协同发挥作用,这项新的研究具有明显的潜力从实验室走向临床应用和改善世界各地癌症患者的治疗效果。
肾细胞癌(RCC)是一个高度未得到满足的需求领域,代表着相当大的患者群体,据估计,美国每年有7.4万新病例和1.5万人死亡。肾癌的新疗法,包括PD-1靶向药物和联合疗法,显示出有希望的初步反应,但CR(完全缓解)率较低,为6-16%,突显了额外治疗选择的必要性。
RCC是一种高度T细胞浸润性肿瘤类型,因此可能适用于基于T细胞的治疗。过继转移表达嵌合抗原受体(CARS)的T细胞是一种有希望的治疗方法,在血液系统恶性肿瘤中显示出显著的益处,包括最近批准的以CD19和BCMA为靶向的CAR T疗法。

在本研究中,研究者首先产生并鉴定了一组基于抗CD70单链抗体的CAR T细胞。尽管CD70在T细胞上表达,但仍能从体外具有较强活性的单链抗体亚群中产生CAR T。CD70 CAR的表达在顺式中屏蔽了CD70的检测,并提供了对CD70 CAR - t介导的自相残杀的保护。两种不同类型的CAR T细胞具有不同的记忆表型、激活状态和细胞毒活性。
表位图谱显示,这两类CARs结合了CD70的独特区域。CD70 CAR T细胞对肾癌细胞株和患者来源的异种小鼠模型显示出强大的抗肿瘤活性。组织交叉反应研究发现淋巴细胞膜染色,从而与已知的CD70表达模式相匹配。
在食蟹猴CD3-CD70双特异性毒性研究中,研究者观察到了与T细胞激活和CD70表达细胞的消除相关的预期结果,包括细胞因子的释放和淋巴组织中细胞的丢失。最后,通过基于TALEN的基因编辑消除T细胞受体,大规模生产高功能的CD70同种异体CAR T细胞。
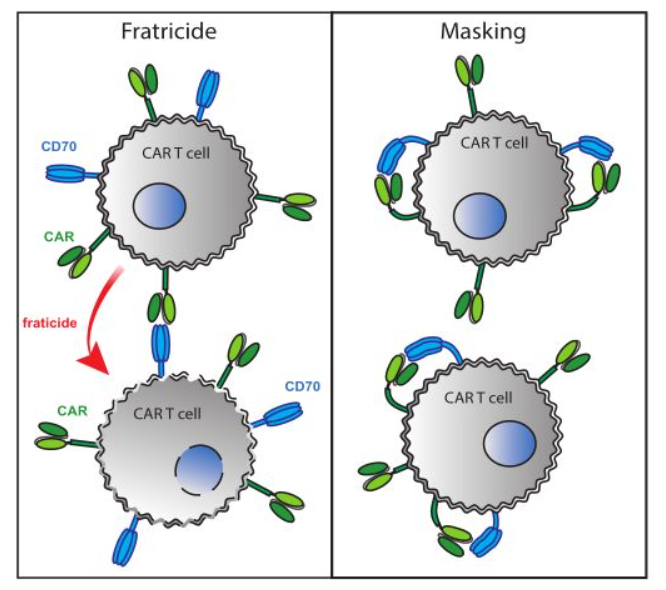
图为 CD70-CAR的表达保护CD70+细胞免受伤害
总之,在这项研究中,研究者发现CD70在肾细胞癌中有较高比例的同源表达,这表明它可能是一个有吸引力的CAR T靶点。与以前的报告一致,研究者还发现活化的T淋巴细胞上有表达。这种表达可能会导致CAR - T细胞自相残杀,正如已经报道的在T细胞上表达的其他肿瘤靶点,如CD38和CD7。尽管有潜在的自杀性,大量基于单链抗体的CD70 CAR被成功地转导并产生了CAR T细胞。
在一项新的研究中,利用在结构生物学领域开发的强大工具和技术,来自美国华盛顿大学和斯克里普斯研究所的研究人员发现了有关人类免疫缺陷病毒(HIV)的新细节。这些发现使人们关注这种病毒表面上下的基本结构,可能有助于设计和开发预防艾滋病(AIDS)的疫苗。相关研究结果发表在2022年2月17日的Cell期刊上,论文标题为“Cryo-ET of Env on intact HIV virions reveals structural variation and positioning on the Gag lattice”。
这些详细的发现包括在整个HIV病毒的背景下,这种病毒的包膜“刺突”蛋白(Env蛋白,在这种病毒与宿主细胞结合时使用)的结构和位置的三维视图。通常情况下,科学家们会观察从这种病毒中分离出来的蛋白颗粒,或者表达为工程蛋白或纯化蛋白。在另一项关键的发现中,这些作者对聚糖屏障(glycan shield)有了新的认识---病毒蛋白表面上存在的可以将HIV隐藏在身体免疫系统之外的糖链。
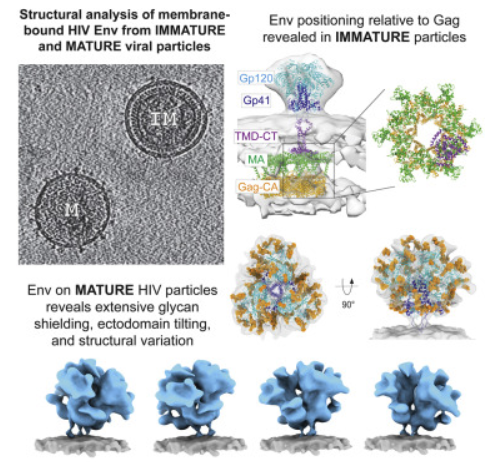
论文共同通讯作者、华盛顿大学药学院药物化学副教授Kelly Lee说,“我们正在研究整个HIV病毒颗粒,以及这种病毒表面上的Env蛋白与该病毒的其他部分有什么联系。通过观察完整的病毒结构,我们可以观察到这个‘病毒脸部’的不同面是如何显示的,以及它们将如何被免疫系统识别或隐藏。”
针对HIV病毒表面上的包膜刺突蛋白相对于该病毒内部蛋白结构(称为Gag晶格)的定位,这种完整的HIV病毒视图还使得这些作者获得了新的见解。
Lee说,“这一发现推翻了以前关于这种病毒各部分如何组装的模型,并有助于将我们的注意力集中在这两种蛋白的对接互动可能在哪里发生。这种对接互动需要更详细地解析出,但这项新的研究至少给我们提供了这种病毒组装的正确架构模型。”
这些作者指出,另一项以前没有观察到的发现是支持病毒包膜蛋白的“柄部(stalk)”是灵活的,可以倾斜,这对免疫系统中保护宿主细胞免受感染的中和抗体来说既是机会又是挑战。
论文共同通讯作者、斯克里普斯研究所免疫学与微生物学副教授Michael Zwick说,“结构生物学已经推动了HIV疫苗的设计,因此当我们越来越好地了解我们的目标是什么时,这激发了创新,并可能导致改进的疫苗。”
Zwick补充说,HIV包膜为疫苗开发提供了一种特别困难的靶标,因为该病毒显示的包膜刺突蛋白非常少,并且用聚糖分子进行伪装,以逃避我们的免疫系统。
Lee说,“所有这些特征增加了HIV包膜刺突蛋白呈现给免疫系统的动态变化性。这是从事HIV疫苗开发的人从一开始就在努力解决的问题---这种病毒以天文数字般的速度发生突变和改变自己。每次它感染一个人,你都会在这个人身上发现数以千计的不同变异,如果你看一下不同的人群,它的变异甚至会更多。”
事实上,在今年2月份,一种更加致命的HIV毒株被发现在荷兰流传。幸运的是,虽然该毒株是一种 “高度毒性的变体”,但它仍然对抗逆转录病毒治疗有反应。
Zwick说,“这只是再次提醒我们,这种病毒总是在变化,所以我们需要科学家们继续研究它。”
在一项新的针对小鼠的研究中,来自美国康奈尔大学、加拿大舍布鲁克大学和英属哥伦比亚大学的研究人员一种新发现的小分子可能能够被喷到人们的鼻子里,以便在暴露之前预防COVID-19疾病,如果在冠状病毒SARS-CoV-2感染后不久就进行治疗,就可能提供早期治疗。相关研究结果于2022年3月28日在线发表在Nature期刊上,论文标题为“A TMPRSS2 inhibitor acts as a pan-SARS-CoV-2 prophylactic and therapeutic”。
这些作者使用了经过基因改造后在细胞表面上表达结合SARS-CoV-2的人类受体的实验小鼠,并发现这种名为N-0385的小分子抑制这种冠状病毒进入小鼠体内的细胞。他们证实作为一种TMPRSS2抑制剂,N-0385能够在小鼠暴露前保护其免受感染,同时在暴露后12小时内给送也能提供有效治疗。
这种治疗方法有希望既能预防疾病,又能降低COVID-19感染后的严重程度和死亡率,只需每天服用几剂。
论文通讯作者、康奈尔大学兽医学院病毒学副教授Hector Aguilar-Carreno说,“已经发现的能够预防感染的小分子抗病毒药物很少(如果有的话)。这是它的第一个例子。一个优点是它在感染的早期就起作用,即使是在人们已经感染病毒之后,也是如此。”
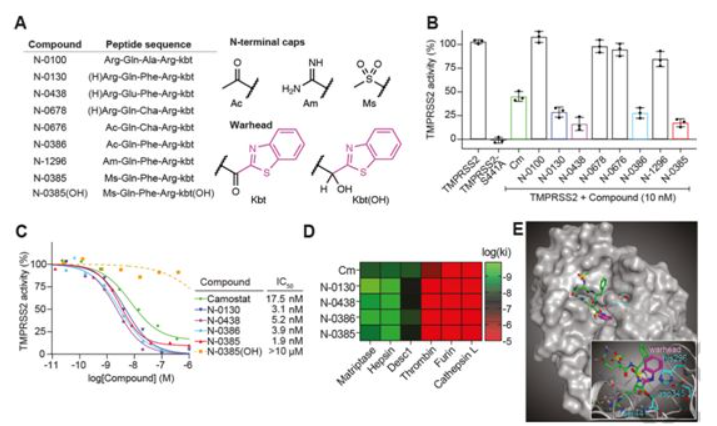
图为 基于酮苯并噻唑(ketobenzothiazole)的模拟肽是有效的TMPRSS2抑制剂
这种广谱疗法在暴露于2020年在美国华盛顿州检测到的首个SARS-CoV-2毒株以及Delta毒株的小鼠身上进行了测试,但还没有在Omicron变体上进行测试,尽管这些作者乐观地认为它将继续有效。
这些作者在感染SARS-CoV-2之前、期间和/或之后将这种小分子经鼻腔递送到小鼠体内。他们跟踪了这些小鼠的体重---因为体重下降是感染的信号,也是疾病的一个很好的指标---以及其他临床和病理指标,如温度和死亡率,还进行了小鼠组织分析,以了解它们如何作出反应。该疗法防止了这些小鼠在暴露于这种冠状病毒之前失去体重,也防止了感染后死亡。Aguilar-Carreno说,即使在感染后12小时内,该疗法也显示出非常好的疗效。
一家位于加利福尼亚的公司---EBVIA治疗公司---目前正在为开展人体临床试验、药物开发、配方和大规模生产筹集资金。如果能迅速筹集到资金,并且如果人体临床试验证明是成功的,该疗法有望能在至少六个月内提交给美国食品药品管理局(FDA)以便获得紧急使用授权。
Aguilar-Carreno说,“与其他类型的COVID-19治疗方法(如单克隆抗体)相比,N-0385药物的大规模生产更简单,成本更低。”
尽管越来越多的研究都揭示了睡眠不足对机体肥胖风险的影响效应,但实验证据非常有限,而且并没有对机体体脂分布相关的研究,近日,一篇发表在国际杂志Journal of the American College of Cardiology上题为“Effects of Experimental Sleep Restriction on Energy Intake, Energy Expenditure, and Visceral Obesity”的研究报告中,来自梅奥诊所等机构的科学家们通过研究发现,睡眠不足及自由进食或会增加机体的卡路里消耗,从而导致脂肪积累,尤其是腹部的不健康脂肪。

在研究人员进行的这项随机对照交叉研究中,他们发现,相比对照睡眠组参与者而言,缺乏足够的睡眠或会让机体总体腹部脂肪面积增加9%,让腹部内脏脂肪量增加11%,内脏脂肪会堆积在腹部深处内部器官周围,同时与机体心脏和代谢性疾病发生密切相关;研究者表示,缺乏充足的睡眠往往是人体的一种行为选择,而这种选择如今变得越来越普遍,在美国有超过三分之一的成年人无法获得充足的睡眠,部分原因是轮班或倒班,或者在传统的睡眠时间使用智能设备和社交网络,此外,人们往往会在较长的清醒时间里吃的更多,同时还不增加体育锻炼。
研究者Virend Somers说道,本文研究结果表明,即使在年龄、健康和相对瘦弱的受试者中,睡眠时间缩短也与机体卡路里摄入量增加有关,同时体重的增加幅度较小,而且机体腹部的脂肪堆积水平也会明显增加。正常情况下,脂肪会优先沉积在皮下,然而,不充足的睡眠似乎会将脂肪转向到更危险的内脏区域,重要的是,尽管在恢复睡眠期间,机体的卡路里摄入和体重会降低,但内脏脂肪量却会增加,这或许就表明,睡眠不足是此前科学家们并没有认识到的引起内脏脂肪堆积的诱发因素,而且至少在短期内,补觉似乎并不会逆转内脏脂肪的堆积,从长远角度来看,这些发现或许表明,睡眠不足是导致肥胖、心血管疾病和代谢性疾病流行的促进因素。

文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




