重磅!下一代癌症免疫疗法即将问世!开发出远程控制的CAR-T细胞,有望更安全更有效地治疗实体瘤
在一项新的针对小鼠的研究中,来自斯坦福大学医学院的研究人员发现一种利用患者自身的经过基因修饰的免疫细胞来攻击癌细胞的癌症治疗方法,当可以通过口服药物进行开启和关闭时,会更安全和更有效。相关研究结果发表在2022年5月12日的Cell期刊上,论文标题为“Enhanced safety and efficacy of protease-regulated CAR-T cell receptors”。
这种称为CAR-T细胞疗法的癌症治疗方法对某些类型的血癌有明显的效果。但是,由于一些患者对这些经过基因改造的T细胞(一种免疫细胞)出现了威胁生命的免疫反应,CAR-T疗法通常只在其他治疗方法被尝试过后才使用。它在实体瘤患者中也不太成功,如脑癌和骨癌患者。科学家们认为,这是因为容易发出过度信号的CAR-T细胞在能够消除实肿瘤之前就已经经历功能衰竭。此外,与血癌不同的是,很难在实体瘤上确定只在癌细胞表面上而不是在正常组织中发现的分子靶标。这些作者设计出一种经过基因修饰的CAR-T细胞疗法---称为SNIP CAR-T,它可用一种已经被美国食品药品管理局(FDA)批准用于人体的抗肝炎口服药物激活。如果没有这种药物,SNIP CAR-T细胞就没有活性。在CAR-T细胞被输注回患者体内后,用药物控制它们的活性的能力为那些可能对经过基因改造的T细胞反应不佳的患者提供了一种安全机制。这些作者还发现,这些经过基因修饰后的CAR-T细胞在治疗实验室小鼠的实体瘤方面明显更有效---可能是因为当这种日常药物在小鼠体内代谢时,CAR-T细胞经历了短暂、反复的休息期。论文通讯作者、斯坦福大学儿科教授Crystal Mackall博士说,“我们构建出一种‘远程控制’的CAR-T细胞疗法,可针对每名患者进行调整。这些经过基因修饰的CAR-T细胞不仅更安全,而且比原来的CAR-T细胞更有效力,用途更广。这是一种相当复杂的系统。”论文第一作者Louai Labanieh说,“我对SNIP CAR-T细胞优于传统CAR-T细胞疗法的程度感到惊讶。在传统CAR-T细胞完全失败的地方,SNIP CAR-T细胞完全治愈了小鼠骨骼和神经系统中的实体瘤。”鉴于这种触发SNIP CAR-T细胞活性的口服药物已经被FDA批准上市,这些作者希望在未来24个月内对患有实体瘤的人进行临床试验。CAR-T细胞是由称为T细胞的免疫细胞制作而成,具体过程为:T细胞从患者身上收集,并在实验室进行基因改造使之表达CAR受体(嵌合抗原受体),以便识别和攻击癌细胞表面上的特定分子。然后将CAR-T细胞输注回同一患者的体内以对抗癌症。当CAR-T细胞表面上的CAR受体与癌细胞表面上的分子靶标结合时,这在CAR-T细胞内启动连锁反应,从而发出杀死癌细胞的信号。CAR-T细胞疗法于2017年首次被FDA批准用于患有急性淋巴细胞白血病的儿童和年轻人。从那时起,它也被批准用于患有其他血癌的成年人,包括多发性骨髓瘤和几种类型的淋巴瘤。这种疗法的原始形式靶向癌细胞表面的一种叫做CD19的分子,但是科学家们也在测试同时识别其他分子靶标的CAR-T细胞。
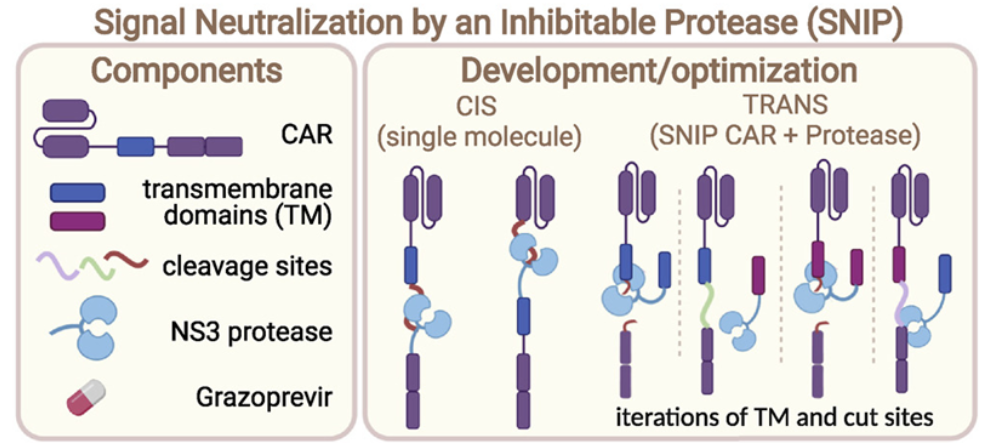

Labanieh希望开发一种CAR-T细胞系统,在CAR-T细胞输注回患者体内后可以很容易地让它们受到控制。他在CAR-T细胞中引入了丙肝病毒NS3蛋白酶。这种蛋白酶切割细胞膜内侧的CAR受体,阻断了触发细胞杀伤活动的信号级联反应。这种蛋白酶可以被一种叫做格佐匹韦(grazoprevir)的药物灭活,这种药物被批准用于治疗丙型肝炎。在没有这种药物的情况下,CAR-T细胞没有活性;当这种药物存在时,CAR-T细胞开始杀死癌细胞。Labanieh和他的同事们发现在没有格佐匹韦的情况下,SNIP CAR-T细胞在实验室小鼠体内没有活性。相反,当小鼠口服格佐匹韦后,这种蛋白酶受到抑制,SNIP CAR-T细胞被激活。在CAR-T细胞诱导出致命毒性的小鼠模型中,用SNIP CAR-T细胞治疗的小鼠在格佐匹韦治疗停止后恢复了健康,这就证实了该系统有可能作为一种比传统CAR-T细胞疗法更安全的替代治疗方案。Labanieh说,“以前构建出药物可调控的CAR-T细胞的努力产生的系统是非常挑剔的,或者说是漏损的。这是我们第一次能够如此精确地调整它们的活性。”Mackall补充说,“当SNIP CAR-T细胞系统与全剂量的格佐匹韦开启时,它是完全开启的。而当格佐匹韦消失时,它就关闭了。这对出现毒副反应的患者来说至关重要。我们可以关闭SNIP CAR-T细胞,让患者有时间恢复。其他大多数安全开关的设计是为了杀死CAR-T细胞,或永远关闭它们。患者可能在这种治疗中存活下来,但他们的癌症仍然没有被治愈。”当这些作者测试SNIP CAR-T细胞对抗小鼠实体癌的能力时,他们发现它们比传统的CAR-T细胞疗法有效得多---在许多情况下,治愈了患有称为髓母细胞瘤的脑癌或称为骨肉瘤的骨癌的小鼠。出乎意料的是,这些作者还发现,调节格佐匹韦的剂量使CAR-T细胞更有辨别力,将它们的杀伤力集中在靶标分子含量高的癌细胞上,而对靶标分子含量较低的正常组织则没有影响。他们说,设计CAR-T细胞以识别也出现在健康细胞表面上的靶分子的能力可能改变治疗人类实体瘤的能力。Mackall说,“这是一种非常有吸引力的可能性。如果我们能通过改变格佐匹韦的剂量来降低SNIP CAR-T细胞的活性,我们就能非常精确地对每名患者进行个性化治疗,防止毒副作用出现或促使CAR-T细胞杀死癌细胞而不是正常组织。我们认为这是一种将改变CAR-T细胞领域的下一代癌症疗法。”
揭示膜结合的ACE2对SARS-CoV-2感染至关重要
在一项新的研究中,来自奥地利科学院分子生物技术研究所、加拿大英属哥伦比亚大学和美国西北大学费恩柏格医学院等研究机构的研究人员发现血管紧张素转换酶2(ACE2)的膜结合形式是使SARS-CoV-2(引起COVID-19的冠状病毒)感染的关键。相关研究结果发表在2022年5月26日的Cell期刊上,论文标题为“Evidence in favor of the essentiality of human cell membrane-bound ACE2 and against soluble ACE2 for SARS-CoV-2 infectivity”。

ACE2有两种形式---一种是可以与健康宿主细胞的细胞膜结合的全长形式,一种是在血液中少量循环的较短的可溶性形式。虽然这两种形式都含有SARS-CoV-2刺突蛋白的受体结合结构域结合的相同序列,但是可溶性ACE2缺乏锚定到细胞膜的能力。论文共同通讯作者、西北大学费恩柏格医学院肾脏病/高血压教授Daniel Batlle博士说,这些研究结果表明,这种全长形式对SARS-CoV-2的感染性至关重要,而可溶性形式并不促进感染性。Batlle说,“这些发现对开发COVID-19领域有希望的涉及可溶性ACE2蛋白的疗法很重要。它们表明极低浓度的可溶性ACE2不会促进SARS-CoV-2的感染性,而高剂量---以中和SARS-CoV-2为目标的剂量---的可溶性ACE2通过拦截这种病毒的刺突蛋白使得它无法到达膜结合的ACE2而达到预期的有益效果。”Batlle实验室和其他实验室在之前的研究已证实当可溶性ACE2蛋白以高剂量给感染SARS-CoV-2的小鼠注射时,病毒复制被阻止,这些小鼠的总体生存率明显提高。然而,其他的研究也提示着在人类肾脏细胞系中,较低浓度的可溶性ACE2实际上可能增加SARS-CoV-2的感染性。这促使Batlle领导的一个国际研究团队利用低浓度的可溶性ACE2蛋白开展进一步的研究。
在这项新的研究中,这些作者通过测量暴露于极低浓度的可溶性ACE2中的人类肾脏细胞系在感染了SARS-CoV-2后的RNA水平来评估病毒感染性。他们还在感染了SARS-CoV-2的人类肺部和肾脏类器官中进行了类似的研究。总的来说,这些作者发现较低浓度的可溶性ACE2并没有增强SARS-CoV-2在肾脏细胞系或肺部和肾脏类器官中的感染性。此外,通过使用一种缺乏ACE2的肾脏类器官新模型,他们发现,在没有ACE2的情况下,SARS-CoV-2的感染性是不可能的。Batlle说,低浓度和高浓度的可溶性ACE2都是如此,它们对SARS-CoV-2感染没有影响,这表明膜结合的ACE2是SARS-CoV-2感染所必需的受体。Batlle说,“可溶性ACE2低浓度存在于正常人、COVID-19和有发生COVID-19并发症风险的心血管疾病患者中,因此,令人放心的是,可溶性ACE2不会促进人类感染。”
揭示使用药用大麻增加心脏病风险,CB1拮抗剂染料木黄酮有望来拯救
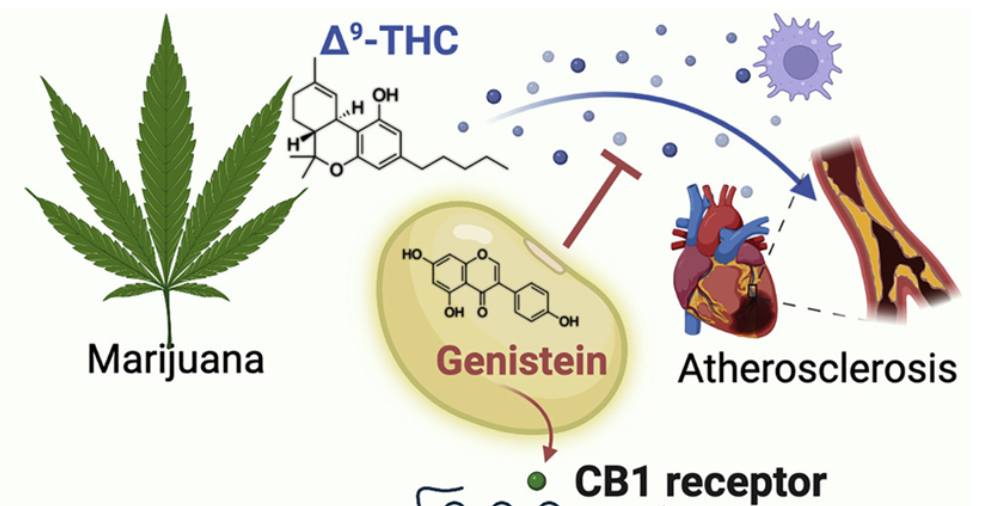
在一项新的大型研究中,来自斯坦福大学医学院研究人员发现使用药用大麻的人患心脏病和心脏病发作的风险增加。他们还发现,大麻的精神活性成分,即四氢大麻酚(tetrahydrocannabinol, THC),会导致位于血管内壁的内皮细胞出现炎症,以及实验室小鼠的动脉粥样硬化。相关研究结果发表在2022年5月12日的Cell期刊上,论文标题为“Cannabinoid receptor 1 antagonist genistein attenuates marijuana-induced vascular inflammation”。
这些作者发现,这种炎症和动脉粥样硬化可以被一种叫做染料木黄酮(genistein)的小分子阻断,这种小分子天然存在于大豆和蚕豆中。因为genistein对大脑的渗透力有限,所以它不会抑制THC刺激食欲、减轻疼痛和抑制恶心的能力---这些特性对药用大麻使用者至关重要。
论文通讯作者、斯坦福大学医学院斯坦福心血管研究所主任Joseph Wu博士说,“随着美国越来越多的州将大麻的娱乐性使用合法化,使用者需要注意它可能对心血管产生副作用。但是genistein能很好地缓解大麻引起的内皮血管损伤,而不会阻断大麻对中枢神经系统的影响,它可能成为药用大麻使用者从心血管角度保护自己的一种方式。”
部分原因是THC在美国是一种受控物质,因此在医学研究中受到严格监管,这些作者提醒道,经常药用大麻的长期健康影响在很大程度上仍不清楚。
论文共同第一作者、斯坦福大学医学院斯坦福心血管研究所医学讲师Mark Chandy博士说,“大麻对心血管系统有明显的不利影响。随着越来越多的州将大麻使用合法化,我预计我们将在未来几年开始看到心脏病发作和中风的上升。我们对人类细胞和小鼠的研究清楚地概述了THC暴露如何在血管中启动一种破坏性的分子级联反应。这不是一种良性的药物。”
THC和炎症
这些作者分析了大约50万名40~69岁的人的遗传数据和医疗数据。这些数据来自英国生物样本库(UK Biobank)。近35000名参与者报告说吸食大麻,其中约11000人每月吸食一次以上。在控制了包括年龄、身体质量指数(BMI)和性别在内的其他因素后,每月抽一次以上的人比研究中的其他人明显更有可能出现心脏病发作。他们发现,经常吸食大麻的人也比不吸食大麻的人更有可能在50岁之前出现第一次心脏病发作---这是一种被称为过早心脏病发作(premature heart attack)的不寻常的医疗事件,它会增加一个人一生中随后心脏病发作、心力衰竭和可能导致突然死亡的危及生命的心律失常的风险。
血管炎症是动脉粥样硬化的一种主要特征。动脉粥样硬化是由于由脂肪、胆固醇和其他物质组成的斑块堆积而导致的血管壁增厚,这可能导致心脏病发作。这些作者发现,吸食大麻烟的志愿者血液中的炎症分子水平在随后的三个小时内明显增加。他们进一步发现,THC在实验室培养的人类内皮细胞中促进炎症和动脉粥样硬化特性。最后,经培育具有高胆固醇水平的喂食高脂肪饮食的实验室小鼠在注射THC时,它们的动脉粥样硬化斑块的大小与每天吸食一支大麻烟的水平相当,明显大于对照组小鼠。
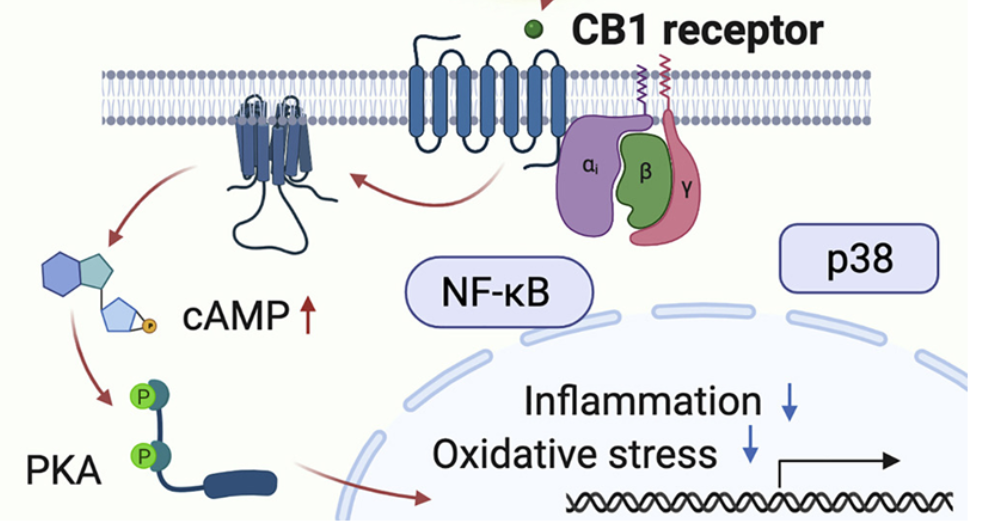
THC与人类大脑、心脏和血管系统中的细胞上一种叫做CB1的受体结合。该受体可识别自然发生的大麻素,即内源性大麻素(endocannabinoid),从而调节情绪、痛觉、免疫功能和代谢。但频繁使用大麻会导致CB1的不适当激活,这可能导致炎症和动脉粥样硬化,并且与肥胖、癌症和糖尿病有关。科学家们一直试图开发称为拮抗剂的分子,在这种受体过度活跃的情况(比如在肥胖中)下阻断CB1的功能,但是在此之前,CB1拮抗剂的使用由于它们在大脑活动中引起的情绪障碍和焦虑等精神方面的副作用而受阻。
寻找CB1拮抗剂
这些作者使用机器学习技术筛选了一个庞大的蛋白结构数据库,并确定了与先前确定的CB1拮抗剂结构相似的分子,这些分子可以阻断THC引起的炎症和动脉粥样硬化特性,而不会引起精神方面的副作用。他们发现大豆中天然存在的分子genistein与CB1结合,但脑部渗透性差。当将genistein添加到经过THC处理的人类内皮细胞中,或者将它提供给具有高胆固醇水平的接受过THC注射的小鼠中时,他们发现genistein阻断了THC的有害作用,但没有阻断THC对大脑的精神作用。
Chandy说,“我们没有看到THC对小鼠正常的止痛或镇静作用受到任何阻断,这些作用有助于大麻的潜在有用的药用特性。因此,与以前的CB1拮抗剂相比,genistein可能是一种更安全的药物。它已被用作一种营养补充剂,而且99%的它停留在大脑之外,因此它应该不会引起这些特定的不良副作用。”
这些作者希望进行临床试验,以了解genistein是否能降低大麻使用者的心血管疾病风险。他们还希望将他们的研究扩展到包括大麻二酚(CBD)---大麻中的另一种大麻素,不具有THC的精神作用。
Wu说,“越来越多的公众认为,大麻是无害的,甚至是有益的。大麻显然有重要的药用价值,但娱乐性使用者应该仔细考虑过度使用的问题。”他指出,一些人将使用大麻的合法化比作电子烟。电子烟最初是作为一种安全的戒烟方式推向市场的,但后来被证明会导致肺部损伤,并导致烟草使用的增加。
利用一种新发现的大脑回路,哺乳动物关注新环境中的最显著特征
在一项新的研究中,来自加州大学旧金山分校的研究人员发现当探索一个新环境时,小鼠利用大脑中一种独特的长距离连接,促使它们注意环境中最显著的特征。这种源于前额叶皮层并延伸到海马体的联系提供了大脑高级认知区域如何优化发生在遥远的大脑区域的操作的证据。相关研究结果发表在2022年4月28日的Cell期刊上,论文标题为“Top-down control of hippocampal signal-to-noise by prefrontal long-range inhibition”。
论文通讯作者、加州大学旧金山分校的Vikaas Sohal博士说,“这个回路是了解大脑如何让前额叶皮层对大脑的其他部分进行自上而下的调节的一个途径。这是一种以前从未见过的连接两个大脑区域的长距离、抑制性途径。”前额叶皮层(PFC),有时被认为是“大脑的CEO”,控制注意力、计划和决策等执行功能。海马体存储记忆并处理空间信息,帮助我们浏览环境。论文第一作者、加州大学旧金山分校的Ruchi Malik博士说,这种新发现的回路有助于将注意力集中在环境中重要的东西上,而忽略其他感官刺激。Malik说,“就好像PFC吸收了所有这些感官信息,并说‘嘿,海马体,我们在这个特定的环境中,所以现在要注意这个特定的信息’。”她以停车场为例,说明PFC对海马体施加了这种自上而下的控制。Malik说,“为了记住你停车的地方,PFC会告诉海马体有选择地注意地标,然后在你返回时回忆并寻找这些地标。”这个回路最独特的地方是它完成集中注意力任务的复杂方式:它通过关闭原本会抑制海马体中微回路的信号,提高和集中这些特定微回路的活动。结果就是PFC发出一个非常明确的信号,告诉海马体应该注意什么,并且随着周围环境的变化,以一种极其巧妙的方式对该信息进行微调。这些作者通过将小鼠放入一个具有有一些小物体的小型竞技场10分钟来证明这一点。在探这个竞技场时,小鼠将检查这些小物体一到两分钟,然后继续前进。通过观察小鼠大脑的活动,他们观察到这两个大脑区域之间的信号是同步的。当小鼠再次经过这些小物体时,他们可以观察到,它们海马体内的信号得到了完善和加强。
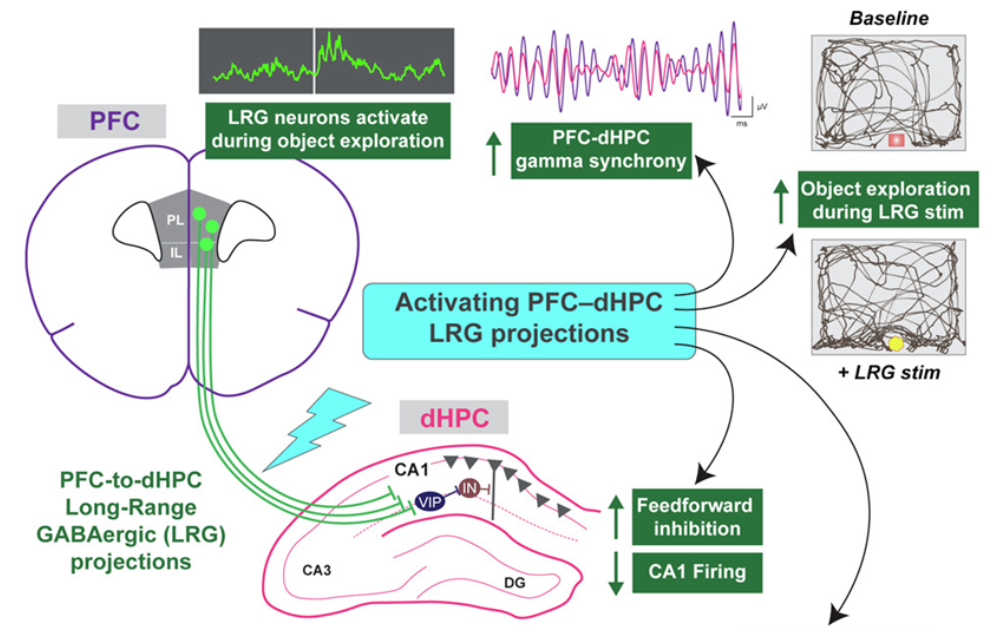
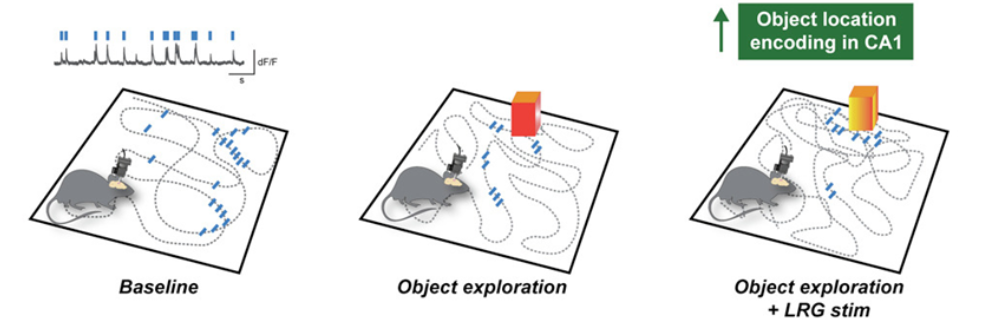
Malik说,“发生了这样的对话;海马体正在绘制物体在空间的位置,而PFC正在指示海马体每个位置的相关性。”
这些作者还发现,这些数据显示哪些神经元在某个特定的时间点上放电,并确定小鼠在那一刻的位置,证实当小鼠接近或探索PFC认为重要的物体时,大脑活动会发生变化。这表明在海马体绘制环境图谱的同时,它也在进行微调,以便在PFC检测到小鼠正在接近一个重要目标(如一个新物体)时产生某些神经活动模式。大脑回路的功能障碍可能与痴呆症、多动症(ADHD)有关这些作者希望更好地了解这一回路在执行功能中可能发挥的作用,以及当它不能有效地完成任务时的后果。Malik认为,这一回路的功能障碍可能是与注意力或记忆有关的认知问题的基础,如痴呆症、多动症或精神障碍。他们针对这个回路迈出的下一步是通过观察这个回路在更复杂的活动中是如何发挥作用的,例如使用存储在工作记忆中的信息来决定遵循哪条路径来寻找奖励,从而了解这个回路如何影响行为。Malik认为,从大脑中更高层次的认知部分到更古老、更普遍的寻路中心的这种联系很可能会产生广泛的影响。她说,“为了在一个复杂的环境中工作,去寻找食物或奖励,然后回来,你需要能够注意特定的刺激,并以精确的方式在空间中安排它们。这个回路的过滤功能是绝对必要的。”
重大进展!作为一类新的药物,反馈干扰剂有望治疗病毒感染甚至癌症
疱疹病毒家族中的病毒是全世界出生缺陷、失明和器官移植失败的主要原因。抗病毒药物可以对抗这些病毒,但是患者往往对这类药物产生抗药性,从而使得它们失去效力。
如今,在一项新的研究中,格拉斯通研究所的Leor Weinberger博士和Sonali Chaturvedi博士及其研究团队开发出一类新的称为反馈干扰剂(feedback disruptors)的药物,它们有可能成为阻止抗药性产生的药物(resistance-proof drug,即防抗药性药物)。相关研究结果于2022年5月12日在线发表在Cell期刊上,论文标题为“Disrupting autorepression circuitry generates 'open-loop lethality' to yield escape-resistant antiviral agents”。

一些对病毒生长至关重要的病毒蛋白在高浓度下会对宿主细胞产生毒性。因此,这些蛋白在水平过高时关闭它们自己的表达,以防止它们所依赖的宿主细胞死亡---这种系统被称为负反馈回路(negative feedback loop)。正如这项新的研究所报道的那样,反馈干扰剂靶向并破坏了这些遗传反馈回路,使受感染的宿主细胞自我毁灭,并阻止感染的发生。纽约州立大学石溪分校生物医学工程系教授Gábor Balázsi博士(未参与这项新的研究)说,“几十年来,对自然界大量存在的遗传反馈回路进行了分析和表征,但是在此之前如何将这些发现转化为药物仍然是一个挑战。这项新的研究首次表明,反馈回路可以成为治疗病毒感染的药物靶标。这是一个全新的抗病毒治疗概念,可以广泛适用。”现有的抗疱疹病毒药物通过毒害疱疹病毒用于在受感染细胞内进行增殖的复制复合物而发挥作用。然而,这些药物所靶向的特定病毒蛋白可以迅速地产生少量的变化,或者说突变,使它们能够逃避攻击。Chaturvedi说,“抗病毒药物的抗药性是一个巨大的问题,影响到全世界数百万人。这就是为什么我如此关心设计阻止抗药性产生的药物。”这种新的反馈干扰方法源于Weinberger实验室早先在巨细胞病毒(CMV)中发现的一种关键反馈回路,其中CMV是一种常见的疱疹病毒类型。在受感染的宿主细胞内,这种反馈回路调节着IE86的产生,这是这种病毒增殖所需的一种蛋白。一旦IE86达到足够高的水平,它就会关闭自己的产生,直到它的浓度下降并稳定下来。这是因为过多的IE86对宿主细胞是有毒的。
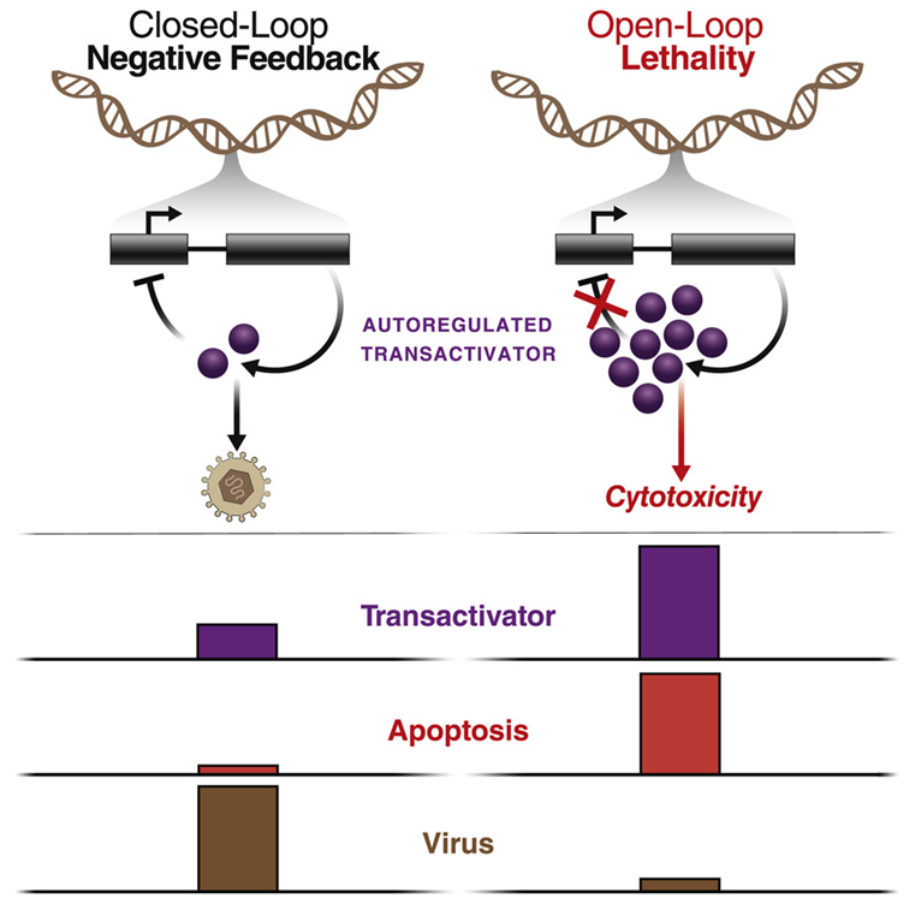
在实验室实验中,当这些作者引入基因改变来移除对这种反馈回路的抑制时,IE86的产生就会飙升,在制造更多的病毒之前摧毁受感染的宿主细胞。Chaturvedi说,“这是违反直觉的,因为我们正在提高一种病毒蛋白的产量,但最终这抵消了感染,而不是使其恶化。”这些作者意识到,如果他们能够开发出一种药物来破坏这种反馈回路,他们就有可能在治疗CMV感染的同时避免抗药性。Weinberger说,“这项新的研究表明,对反馈干扰剂的抗药性需要CMV在多个不同的基因组位置进行大量的突变,从而在本质上重建一种新的反馈回路。这种情况发生的可能性微乎其微,我们的实验室实验重现了这一点;CMV对目前的抗病毒药物进化出抗药性没有什么问题,但却无法进化出对反馈干扰剂的抗药性。”如今,面临的挑战是开发这样的一种候选药物。通过采用生化实验、数学建模和合成生物学,这些作者开发了一种与IE86结合的小片段合成DNA,它可阻断IE86的产生。他们将这种新的候选药物称为反馈干扰剂。额外的实验室实验表明,这种反馈干扰剂确实杀死了CMV感染的宿主细胞,但却没有伤害到健康的宿主细胞。在一项关键的实验中,这些作者发现这种反馈干扰剂对宿主细胞中的CMV持续有效达数月之久,而这种病毒从未产生抗药性。相比之下,CMV可以在短短2天内对抗病毒药物阿昔洛韦(acyclovir)产生抗药性。他们还发现,感染了某种版本的CMV的小鼠在接受反馈干扰剂治疗时比接受安慰剂治疗时效果更好。接下来,这些作者证实反馈干扰剂可能被开发出来以靶向其他病毒使用的类似反馈回路,首先是导致失明的主要传染性原因---单纯疱疹病毒1(HSV-1)。他们发现,在感染HSV-1后,接受反馈干扰剂治疗的小鼠眼睛的病毒感染率明显下降。此外,这些作者还开发了一种针对SARS-CoV-2(引起COVID-19的冠状病毒)的反馈干扰剂,在细胞实验中显示出有希望的抗病毒效果。Chaturvedi说,“这非常令人鼓舞,因为它表明这种反馈干扰器策略不限于基于DNA的病毒,如CMV和HSV-1,也可以为诸如SARS-CoV-2之类的RNA病毒设计。”事实上,这些作者预计,同样的策略可能应用于任何涉及在遭受破坏时过度产生一种关键蛋白的反馈回路的疾病。如今,这些作者正在努力确定反馈回路是否可能在癌症中加以靶向,毕竟癌症是另一类具有重大抗药性挑战的疾病。在未来,反馈干扰剂也有可能被开发出来,以对抗细菌性疾病。与此同时,针对疱疹病毒的反馈干扰剂进行更多的实验室研究可能使这种策略更接近于临床测试。Weinberger说,“现在迫切需要更好的方案来治疗病毒感染,如CMV和HSV-1,这些病毒对目前的抗病毒药物产生了抗药性。反馈回路已经被研究了几十年,如今我们可能能够靶向它们,以克服抗药性。”
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。
返回列表


















 京公网安备 11011402010692号
京公网安备 11011402010692号




