众所周知,随着我们年龄的增长,获得良好的睡眠变得更加困难,但为什么会发生这种情况的基本生物学知识仍然知之甚少。在一项新的研究中,来自美国斯坦福大学等研究机构的研究人员如今确定了参与调节小鼠睡眠和觉醒的大脑回路是如何随着时间的推移而退化的,这为人类开发更好的药物铺平了道路。相关研究结果发表在2022年2月25日的Science期刊上,论文标题为“Hyperexcitable arousal circuits drive sleep instability during aging”。 论文通讯作者、斯坦福大学教授Luis de Lecea博士说,“超过一半的65岁及以上的人抱怨睡眠质量不好。” 已有研究表明,睡眠不足与多种不良健康结果的风险增加有关,从高血压到心脏病发作、糖尿病、抑郁症和与阿尔茨海默病有关的大脑斑块堆积。失眠通常用一类称为催眠药(hypnotics)的药物---包括安必恩(Ambien)---来治疗,但这些药物在老年人群中的效果并不理想。 在这项新的研究中,de Lecea及其同事们决定研究下丘脑分泌素(hypocretin,也译作下视丘分泌素),其中下丘脑分泌素是关键的大脑化学物,仅由位于眼睛和耳朵之间的大脑下丘脑中的一小簇神经元产生。在大脑中的数十亿个神经元中,只有大约5万个能产生下丘脑分泌素。 1998年,de Lecea和其他科学家已发现下丘脑分泌素传递的信号在稳定清醒状态方面起着重要作用。鉴于许多物种在年老时都会经历支离破碎的睡眠,因此人们推测,同样的机制在整个哺乳动物中起作用,而且先前的研究已表明下丘脑分泌素的降解导致人类、狗和小鼠出现嗜睡症(narcolepsy)。
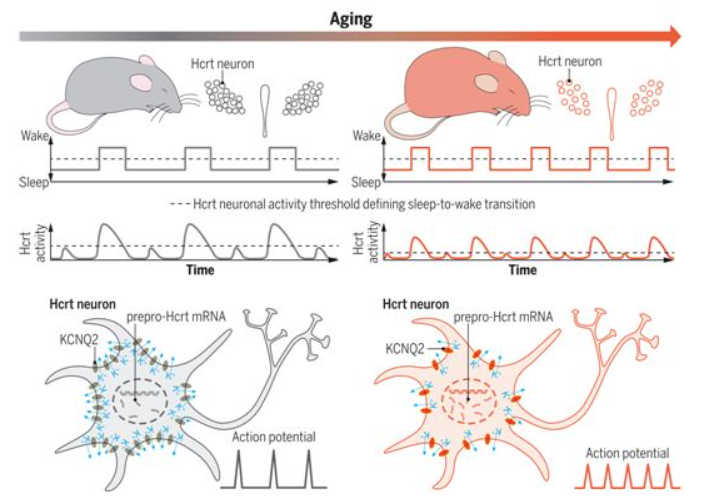
在这项新的研究中,这些作者选择了年轻的小鼠(3至5个月)和年老的小鼠(18至22个月),并使用纤维携带的光来刺激特定的神经元。他们用成像技术记录了实验结果。他们发现与年轻的小鼠相比,年老的小鼠已经失去了大约38%的下丘脑分泌素。他们还发现,留在年老小鼠体内的下丘脑分泌素更容易兴奋,也更容易受到触发,使得这些动物更容易醒来。
这可能是因为“钾离子通道”随着时间的推移而退化,其中钾离子通道是对许多类型的细胞的功能至关重要的生物开关。de Lecea说,“这些神经元往往更活跃,更多地放电,如果它们更多地放电,你就会更频繁地醒来。”
澳大利亚弗洛里神经科学与精神健康研究所的Laura Jacobson和Daniel Hoyer在一篇相关的评论文章中认为,确定导致睡眠损失的具体途径可能会导致更好的药物。他们说,目前的治疗方法,如催眠药,“可能会诱发认知损伤和跌倒”,而靶向特定离子通道的药物可能效果更好。
de Lecea说,这些药物将需要在临床试验中进行测试,但是目前用于治疗癫痫的一种靶向类似途径的名为瑞替加滨(retigabine)的现有药物可能很有希望。
在一项新的研究中,来自德国康斯坦茨大学、瑞士苏黎世联邦理工学院和美国加州理工学院的研究人员解决了一种已存在25年的难题:细胞中蛋白如何分选。一种称为NAC(nascent polypeptide-associated complex, 新生多肽复合物)的蛋白复合物在蛋白合成中充当“守门员”,调节着蛋白在细胞内的运输。他们阐明了这种功能背后的分子机制。相关研究结果发表在2022年2月25日的Science期刊上,论文标题为“Mechanism of signal sequence handover from NAC to SRP on ribosomes during ER-protein targeting”。 为了维持我们的细胞功能,当蛋白仍在合成时,就必须将它们运输到细胞中多种称为“细胞器”的目的地。但是,如何才能区分不同的运输目的地并防止蛋白到达错误的细胞器呢?这些作者如今发现了为了使蛋白运输到一个重要的细胞目的地---将新生的蛋白运送到细胞中的一种膜网络,即内质网,这种复杂的过程如何在分子水平上受到控制。 在这项新的研究中,这些作者能够发现一种被专家们称为NAC的蛋白质复合物在这一过程中起着决定性的作用,该复合物是在25年前发现的。像守门员那样,NAC确保只有以内质网为目的地的蛋白被传递给蛋白转运体SRP(signal recognition particle, 信号识别颗粒)。然后SRP介导这种蛋白“货物”运输到指定的目的地。另一方面,如果新生蛋白的目的地不是内质网,守门员NAC会拒绝蛋白转运体SRP的访问。 蛋白工厂 以遗传物质为蓝本,我们身体的细胞中每分钟都会产生成千上万的新蛋白。这种蛋白产生是在核糖体中进行的,核糖体是我们身体的细胞“工厂”,在那里不同的氨基酸---蛋白的构成单元(building block)---被组装成长的氨基酸链。由此产生的蛋白后来可以承担各种各样的功能,并相应地在细胞内有不同的目的地。因此,适当的分选机制往往已经确保在蛋白生产过程中,蛋白可靠地到达细胞内的各自位置。 到目前为止,人们知道两种蛋白质复合物,即上述的NAC和SRP,在新生蛋白向内质网的靶向运输中起着重要作用。SRP是实际的“运输蛋白”,它建立了新生蛋白与核糖体到内质网的联系。它能识别新合成的蛋白中编码的特定运输信号。然而,有一个问题:SRP也非特异性地与没有内质网信号的核糖体结合。 论文共同通讯作者、康斯坦茨大学分子微生物学教授Elke Deuerling解释说,“在不受控制的情况下,SRP会与附近的任何核糖体结合,然后将它运送到内质网,而不管它目前是否正在制造到达这种目的地的蛋白。这将导致无数的错误递送,严重损害细胞的功能和生存能力。”因此,这些作者得出结论,有一种控制实体正好可以防止这种情况:守门员NAC。 追踪分子机制 NAC究竟如何在分子水平上阻止SRP与任何核糖体非特异性地结合,而是确保只有正确的核糖体被运送到内质网,在此之前并不清楚。在这项新的研究中,这些作者探究了这个问题。 为了做到这一点,他们首先通过将纯化的核糖体与NAC和SRP在试管中混合在一起来模拟细胞内的过程。并在电子显微镜下将样本混合,然后将该混合物在零下150℃的温度下快速冷冻--这种方法被称为低温电镜。这使得结构生物学家Ahmad Jomaa博士(论文共同第一作者)和Viswanathan Chandrasekaran博士(论文共同作者)能够揭示NAC在蛋白货物转移到SRP之前和之后如何与核糖体结合。这是阐明这种守门员机制的一个重要基石,但是这两种状态之间的过渡仍然不清楚。
论文共同第一作者、康斯坦茨大学的Martin Gamerdinger博士解释说,“这种过渡是一个高度动态的过程,无法通过低温电镜来观察。”为了了解这个过程,他和他的团队(博士研究员Annalena Wallisch和Zeynel Ulusoy)进行了高分辨率的生化结合研究,详细揭示了NAC与核糖体的相互作用机制取决于合成的蛋白类型。
作为守门员的NAC
利用这种方法和计算机辅助重建的三维结构,以及Hao-Hsuan Hsieh博士对相关成分之间的结合强度的实验,这些作者成功地破译了NAC在分子水平上的工作原理。根据他们的研究结果,他们能够为NAC的分选功能提出一种详细的分子机制。
据此,NAC与核糖体结合,特别是与新生蛋白离开核糖体的部分结合。就像守门员那样,NAC的一部分保护性地位于这个出口---核糖体通道(ribosomal tunnel)---的前面,并阻止SRP访问核糖体和新生蛋白。只有当新生蛋白中编码的内质网运输信号序列在蛋白合成过程中离开核糖体通道时,才允许访问。NAC识别这个信号并改变它在核糖体上的位置。这样一来,核糖体通道的出口就变得畅通无阻,SRP在通过NAC的“抓取臂”---UBA结构域---被主动招募到核糖体上后,如今可以停靠到核糖体通道的出口上。在SRP结合和信号序列转移后,核糖体与新生蛋白一起被运送到内质网。
Deuerling教授总结了这一基本控制机制,说道,“我们的研究揭示了NAC作为守门员的分子功能,只允许SRP访问那些目的地为内质网的新生蛋白。”她同意她的国际合作伙伴Nenad Ban教授(苏黎世联邦理工学院)、Shu-ou Shan教授(加州理工学院)和Ramanujan Hegde教授(英国MRC-LMB)的看法:“未来的研究将不得不揭示NAC是否在核糖体通道也有其他控制功能。”
在一项新的研究中,来自美国麻省理工学院的研究人员开发出一种合成黑莫他丁(himastatin)的新方法,其中黑莫他丁是一种天然化合物,已经显示出作为抗生素的潜力。相关研究结果发表在2022年2月25日的Science期刊上,论文标题为“Total synthesis of himastatin”。 利用这种新的合成方法,他们不仅能够制造黑莫他丁,而且能够产生这种分子的变体,其中一些变体也显示出抗菌活性。他们还发现,这种化合物似乎通过破坏细菌的细胞膜来杀死细菌。他们如今希望能设计出其他可能具有更强抗生素活性的分子。 论文共同通讯作者、麻省理工学院化学教授Mohammad Movassaghi说,“我们如今想做的是了解关于它如何发挥作用的分子细节,以便我们能够设计出能够更好地支持这种作用机制的结构基序。我们如今的很多研究工作是要更多地了解这种分子的物理化学特性以及它如何与细胞膜相互作用。” 模拟自然 由一种土壤细菌产生的黑莫他丁在20世纪90年代首次被发现。在动物研究中,它被发现具有抗癌活性,但所需的剂量有毒副作用。Movassaghi说,这种化合物还显示出潜在的抗菌活性,但这种潜力还没有被详细探索。 黑莫他丁是一种复杂的分子,由两个相同的称为单体的亚基组成,它们结合在一起形成二聚体。这两个亚基通过一个碳-碳键连接在一起,该碳-碳键将一个单体中的一个六碳环连接到另一个单体中相同的环上。 这个碳-碳键对于这种分子的抗菌活性至关重要。在以前合成黑莫他丁的研究工作中,科学家们曾试图首先使用两个简单的亚基来制造该碳-碳键,然后在单体上添加更复杂的化学基团。 这些作者采取了一种不同的方法,其灵感来自于产生黑莫他丁的细菌中进行这种反应的方式。这些细菌有一种酶,可以在黑莫他丁合成的最后一步通过将需要连接在一起的每个碳原子变成高活性的自由基将两个单体连接起来。

为了模拟这一过程,这些作者首先从氨基酸构成单元中构建出复杂的单体,这得到了论文共同通讯作者、麻省理工学院化学教授Brad Pentelute实验室之前开发的一种快速肽合成技术的帮助。
论文第一作者、麻省理工学院研究生Kyan D'Angelo说,“通过使用固相肽合成技术,我们可以快速完成许多合成步骤,并轻松混合和匹配构成单元。这只是我们与Pentelute实验室的合作非常有帮助的方式之一。”
这些作者随后使用了Movassaghi实验室开发的一种新的二聚化策略,将两个复杂的分子连接在一起。这种新的二聚作用是基于苯胺的氧化,在每个分子中形成碳自由基。这些自由基可以反应形成这个将两个单体钩在一起的碳-碳键。利用这种方法,他们可以构建出包含不同类型亚基的二聚体,此外还有自然发生的黑莫他丁二聚体。
Movassaghi说,“我们对这种类型的二聚化感到兴奋的原因是,它允许你真正地使结构多样化,并非常迅速地获得其他潜在的衍生物。”
膜破坏
这些作者构建出的黑莫他丁变体之一有一个荧光标签,他们用该变体来观察黑莫他丁与细菌细胞的相互作用方式。利用这些荧光探针,他们发现,该药物在细菌细胞膜上聚集。这使他们推测,它是通过破坏细胞膜来发挥作用的,这也是至少一种美国食品药品管理局(FDA)批准的抗生素---达托霉素(daptomycin)---所使用的机制。
这些作者还通过在这种分子的特定部分交换不同的原子,设计出几种其他黑莫他丁变体,并测试了它们对六种细菌菌株的抗菌活性。他们发现这些化合物中的一些具有很强的活性,但只有当它们包括一个天然存在的单体和一个不同的单体时才有活性。
D'Angelo说,“通过将这种分子的两个完整的半边放在一起,我们可以制造出一种只有一个荧光标签的黑莫他丁衍生物。只有用这个版本,我们才能进行显微镜研究,提供黑莫他丁在细菌膜内定位的证据,因为有两个标签的对称版本没有正确的活性。”
这些作者如今计划设计更多的黑莫他丁变体,他们希望这些变体可能具有更强的抗生素活性。Movassaghi说,“我们已确定了我们进行衍生化的位置,这些位置有可能保留或增强活性。真正让我们感到兴奋的是,我们通过这个设计过程获得的大量衍生物都保持了它们的抗菌活性。”
在一项新的研究中,来自意大利米兰大学、瑞典乌普萨拉大学和哥德堡大学等研究机构的研究人员通过将人类群体研究与针对细胞和动物模型的实验联系起来,提供了证据表明内分泌干扰物(endocrine-disrupting chemical, EDC)的复杂混合物影响儿童的大脑发育和语言习得。通过他们的新方法,他们表明,多达54%的孕妇接触到了实验确定的令人担忧的EDC水平。虽然目前的风险评估是逐个地研究EDC,但是这些发现表明,未来的风险评估方法需要考虑到EDC的混合物。相关研究结果发表在2022年2月18日的Science期刊上,论文标题为“From cohorts to molecules: Adverse impacts of endocrine disrupting mixtures”。 越来越多的证据表明,我们不断接触的环境化学物可能具有干扰内分泌的特性,因此可能对人类和动物的健康和发育造成危害。每年都会有大量新化合物的释放,作为一系列商品的市场授权和生产过程的一部分,这些商品主要是塑料衍生物,而不仅仅是塑料衍生物,从水、食物和空气等多种来源进入人体。 虽然单个化学物的暴露水平通常低于现有的极限值,但暴露于复杂混合物中的相同化学物仍会影响人类健康。然而,所有现有的风险评估,以及由此确立的限值,都是基于对化学物的逐一检查。因此,非常有必要测试是否有可能采取另一种策略,即在流行病学和实验环境中,对现实生活中接触的实际混合物进行测试。欧盟资助的EDC-MixRisk项目着手解决这一未满足的需求。
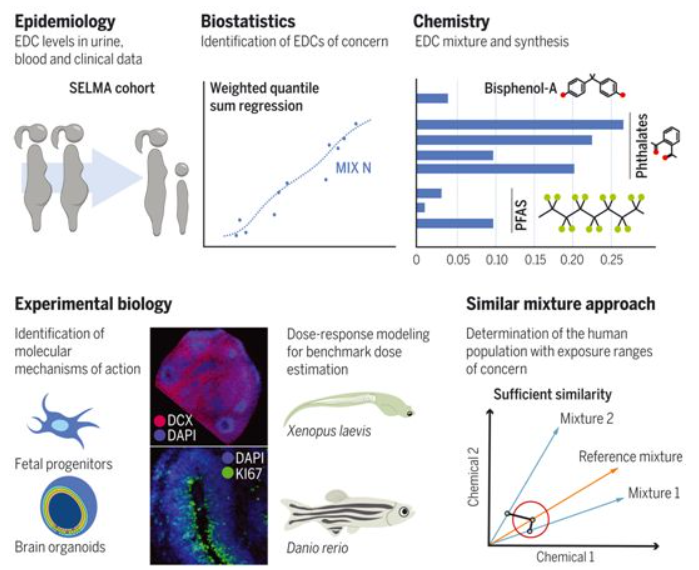
图表显示了这项研究的整体框架
论文共同作者、瑞典卡尔斯塔德大学教授、SELMA研究的项目经理Carl-Gustaf Bornehag说,“这个综合项目的独特之处在于,我们将人群数据与实验研究联系起来,然后利用这些信息来开发化学混合物的风险评估新方法。”
这项新的研究分三个步骤进行:(1)在瑞典怀孕队列SELMA研究中发现了孕妇血液和尿液中与30个月大的儿童语言发育延迟有关的化学混合物。这种关键混合物包括一些邻苯二甲酸盐、双酚A和全氟化学物;(2)实验研究发现了分子靶标,这种混合物在人类相关水平下通过这些分子靶标破坏了内分泌回路和对与自闭症和智力障碍相关的基因的调节;(3)这些实验研究的结果用于制定对这种混合物进行风险评估的新原则。
论文共同通讯作者、乌普萨拉大学环境毒理学教授、EDC-MixRisk副协调员Joëlle Rüegg说,“令人震惊的是,通过这些实验研究取得的发现很好地反映了我们在流行病学部分的发现,而且这些影响可以在人体的正常暴露水平上得到证实。”
论文共同作者、负责这种人类实验建模的EDC-MixRisk首席研究员Giuseppe Testa说,“人脑类器官(复杂的体外培养物,可再现人类大脑发育的显著方面)首次提供了机会来直接探测这种混合物对人类大脑组织的分子影响,其阶段与怀孕期间测量的阶段相匹配。与其他实验系统和计算方法一起,我们发现这种混合物破坏了与自闭症(其特征之一是语言障碍)有关的基因调节,阻碍了神经元的分化并改变了神经组织中的甲状腺激素功能。”
论文共同通讯作者、法国巴黎自然历史博物馆生理学与内分泌学教授Barbara Demeneix说,“受影响的关键激素途径之一是甲状腺激素。在怀孕早期,大脑的生长和发育需要母体甲状腺激素的最佳水平,因此,产前暴露与语言延迟之间存在联系就不足为奇了。”
通过以这种方式将不同的科学方法联系起来,这些作者能够发现这项SELMA研究纳入的54%的儿童有语言发育迟缓的风险(在30个月大时),因为他们在产前接触的化学混合物的水平高于预测的影响神经发育的水平。如果使用单个化学物的现行限值,这种风险并不明显。
许多令人印象深刻的大脑病变与主要的脑血管缺陷密切相关,而目前由于缺乏药物,这些缺陷无法得到治疗。在一项新的研究中,来自比利时布鲁塞尔自由大学的研究人员取得特别有希望的发现:他们不仅开发出一类新的特异性校正这些功能障碍的分子:工程化的Wnt,而且还在完全不同的大脑病变的小鼠模型中展示了它们的有效性。相关研究结果发表在2022年2月18日的Science期刊上,论文标题为“Engineered Wnt ligands enable blood-brain barrier repair in neurological disorders”。论文通讯作者、布鲁塞尔自由大学科学学院分子生物学系教授Benoit Vanhollebek博士。
Vanhollebek团队专门研究脑血管及其功能障碍。通过研究在胚胎期控制这些血管形成的蛋白,他们认为他们可以确定具有良好治疗潜力的靶标:Gpr124/Reck膜复合物,它的作用之前已在神经发育背景下揭示出。他们发现的证据是通过开发靶向Gpr124/Reck膜复合物的分子,他们成功地减缓了小鼠胶质母细胞瘤(最常见的成年原发性脑癌)的进展,并减少了中风后的病变。
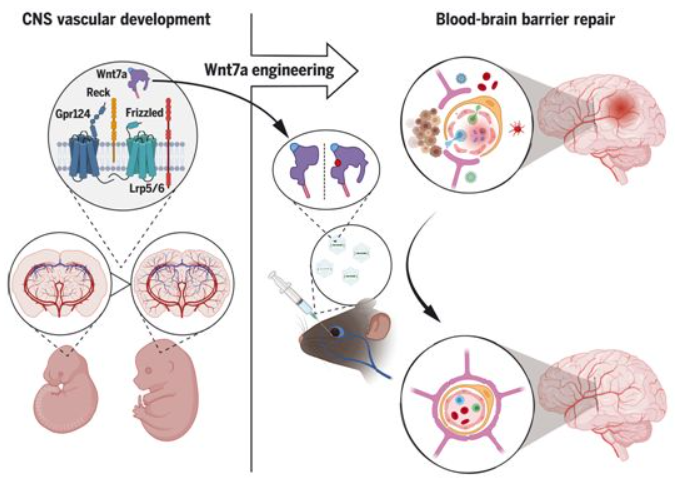
图为 Wnt7a配体在血脑屏障缺陷治疗中的应用
Vanhollebek团队此前在Science期刊上发表了关于这种治疗靶标的机制特征。这项新研究确定了它在小鼠身上的治疗潜力。当该靶标遭受激活时,因病变而变得过度具有渗透性的功能失调的脑血管恢复了其原有的功能;它们恢复了一系列强烈限制血液和神经组织之间交流并被统称为血脑屏障(blood-brain barrier)的细胞和分子特征。因此,大脑再次受到保护,不受血液中循环的有毒成分的影响,而且大脑病变的进展也减缓了。
Vanhollebek解释说,“这项研究最吸引人的方面之一是病变的大脑血管对这种实验性治疗的反应的特异性水平。受自然发育过程的启发,我们设计了一类新的分子,能够有效地到达它们的治疗靶标,同时对健康血管和身体其他组织保持完全惰性。从根本上说,这种程度的特异性似乎是之前无法达到的。”
在此基础上,这些作者如今希望探索其他有可能从他们的方法中受益的大脑病变实验模型。
正如正在进行的冠状病毒SARS-CoV-2大流行所证明的那样,病毒基因序列的新突变可以对病毒的传播性和造成的损害产生重大影响。多年来,人们一直担心HIV-1病毒会出现这种情况。根据联合国艾滋病规划署的统计数据,HIV-1已经影响到全球3800万人,迄今已造成3300万人死亡。 在一项新的研究中,英国牛津大学大数据研究所的研究人员领导的一个研究团队证实在荷兰发现了一种新的、高毒性的称为VB变体(VB variant)的HIV毒株。相关研究结果发表在2022年2月4日的Science期刊上,论文标题为“A highly virulent variant of HIV-1 circulating in the Netherlands”。 在接受抗逆转录病毒治疗(ART)之前,感染了这种VB变体的人与感染了其他HIV变体的人相比显示出明显的差异:(1)感染VB变体的人的病毒载量(血液中的病毒水平)高出3.5到5.5倍;(2)此外,感染VB变体的人体内CD4 T细胞减少的速度(这是HIV对免疫系统造成损害的标志)比其他HIV变体快两倍,使这些感染者更快面临发展为艾滋病(AIDS)的风险;(3)感染VB变体的人还显示出将这种病毒传播给他人的风险增加。
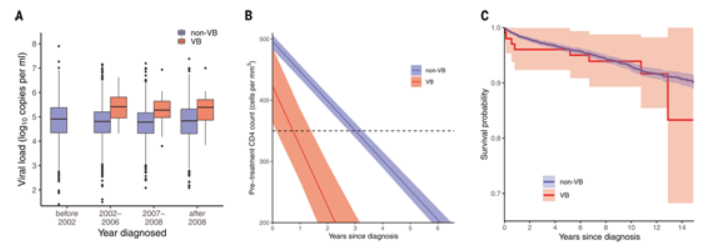
图为 VB变体感染者的临床特点
令人欣慰的是,在开始治疗后, VB变体感染者的免疫系统恢复和生存率与其他HIV变体患者相似。然而,这些作者强调,由于VB变体导致免疫系统强度更快速的下降,这使得感染者尽早被诊断并尽快开始治疗变得至关重要。
进一步研究了解导致VB变体更具传播性和对免疫系统的破坏性的机制可能能够发现下一代抗逆转录病毒药物的新靶标。VB变体的特点是许多突变分布在整个基因组中,这意味着在这个阶段不能确定单一的遗传原因。
论文共同通讯作者、牛津大学大数据研究所的Chris Wymant博士说,“在这项研究之前,人们知道HIV病毒的遗传学与毒力有关,这意味着一种新变体的进化可能改变它对健康的影响。VB变体的发现证明了这一点,为病毒毒力进化所带来的风险提供了一个罕见的例子。”
论文共同通讯作者、牛津大学大数据研究所的Christophe Fraser教授补充说,“我们的研究结果强调了世界卫生组织(WHO)指南的重要性,即有可能感染HIV的个人可以获得定期检测,以便早期诊断,然后立即治疗。这限制了HIV损害个人免疫系统和危害其健康的时间。它还能确保HIV尽快得到抑制,从而防止传染给其他个人。”
VB变体首先在BEEHIVE项目的17名HIV阳性者中发现,该项目是一项正在进行的从欧洲和乌干达各地收集样本的研究。由于这些人中有15人来自荷兰,这些作者随后分析了来自荷兰6700多名HIV阳性者的队列数据。这确定了另外92名来自荷兰所有地区的感染该变体的人,使得总人数达到109人。
通过分析这些样本中的遗传变异模式,这些作者估计VB变体是在20世纪80年代末和90年代在荷兰首次出现的。在2000年代,它比其他HIV变体传播得更快,但自2010年左右开始,它的传播速度一直在下降。他们认为,尽管在荷兰进行了广泛的治疗,但VB变体还是出现了,其中的原因不在于这种治疗,毕竟有效的治疗可以抑制传播。
感染VB变体的人显示了荷兰HIV感染者的典型特征,包括年龄、性别和可疑的传播方式。这表明VB变体的传播性增加是由于这种病毒本身的特性,而不是病毒携带者的特性。
在一项新的研究中,来自英国布里斯托大学的研究人员发现,蛋白p53在上皮细胞迁移和组织修复中起着关键作用。这些发现可以提高我们对细胞用来修复组织的过程的理解,并可用于确定潜在加快和改善伤口修复的干预措施。相关研究结果近期发表在Science期刊上,论文标题为“p53 directs leader cell behavior, migration, and clearance during epithelial repair”。 上皮组织保护身体外部皮肤和内部空腔,它们的自我修复的能力非常重要。众所周知,受伤的上皮组织能够自我修复,这要归功于剩余细胞集体开始迁移,以封闭伤口。称为领导细胞(leader cell)的特化迁移细胞产生于受损的上皮细胞,促进上皮细胞迁移。然而,目前还不清楚上皮细胞中的什么分子和信号使它们成为迁移的领导细胞,以及一些受伤的上皮细胞如何产生领导细胞的行为而另一些受伤的上皮细胞没有。 这项研究发现当上皮细胞遭受损伤时,这种损伤会激活一种分子程序,使受损的上皮细胞变成迁移性的领导细胞,从而使伤口能够迅速修复。同样的分子程序还确保这些高度迁移的领导细胞在伤口封闭时被移除,从而使组织恢复其正常的上皮组织结构。 通过使用一种简化的伤口模型,即在体外划伤上皮单层以使其遭受损伤,这些作者确定了使领导细胞出现的分子信号。
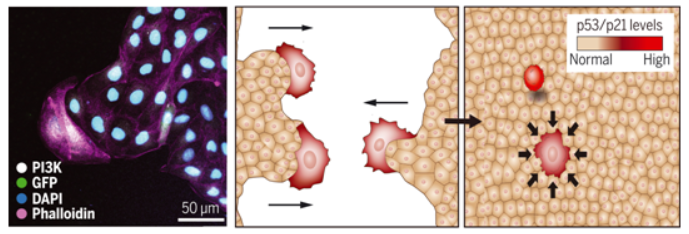
图为 p53和p21诱导领导细胞行为并驱动它们在上皮细胞修复期间的迁移
他们发现在遭受损伤后,上皮单层伤口边缘的上皮细胞上调表达了p53和p21,这表明伤口触发了这种迁移程序。一旦缺口被修复,领导细胞就会被它们的健康的上皮细胞邻居从群体中清除。受伤的上皮细胞能够导致伤口闭合,但随后被清除掉,以维持具有正常上皮形态的功能组织。
论文通讯作者、布里斯托大学细胞与分子医学学院高级研究员Eugenia Piddini说,“我们的发现提高了我们对细胞用于修复组织的机制的理解,并可能用于开发加快伤口愈合的系统。p53在上皮修复中起着两个关键作用。它启动领导细胞驱动的上皮闭合,一旦上皮被修复,p53会诱导领导细胞的清除。”
论文共同第一作者、布里斯托大学细胞与分子医学学院研究助理Giulia Pilia博士补充说,“集体迁移在其他领域也很重要,例如在癌症中,成群的癌细胞从原发肿瘤中一起移动,形成转移灶。了解我们在这种伤口模型中发现的相同蛋白是否在这种情况下起作用将是非常重要的,这样就可以对目前的治疗方法进行修改。”
这项研究的下一步将是测试在体外上皮组织中发现的机制是否也适用于体内。如果是这样的话,这些作者希望测试他们是否能在体内选择性地和安全地诱导领导细胞激活,以促进迁移和组织修复。这种关于领导细胞如何发挥作用的新发现的知识也可用于开发新的治疗方法,以帮助阻止转移性细胞的不必要的迁移。
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




