在一项新的研究中,来自美国西达赛奈医学中心的研究人员发现了为什么有些受伤的肾脏可以愈合,而有些则会形成瘢痕,导致肾衰竭。他们的发现可能有助于开发检测肾脏瘢痕的非侵入性测试,并最终开发出逆转肾脏瘢痕的新疗法。相关研究结果发表在2024年2月23日的Science期刊上,论文标题为“GABAergic regulation of striatal spiny projection neurons depends upon their activity state”。

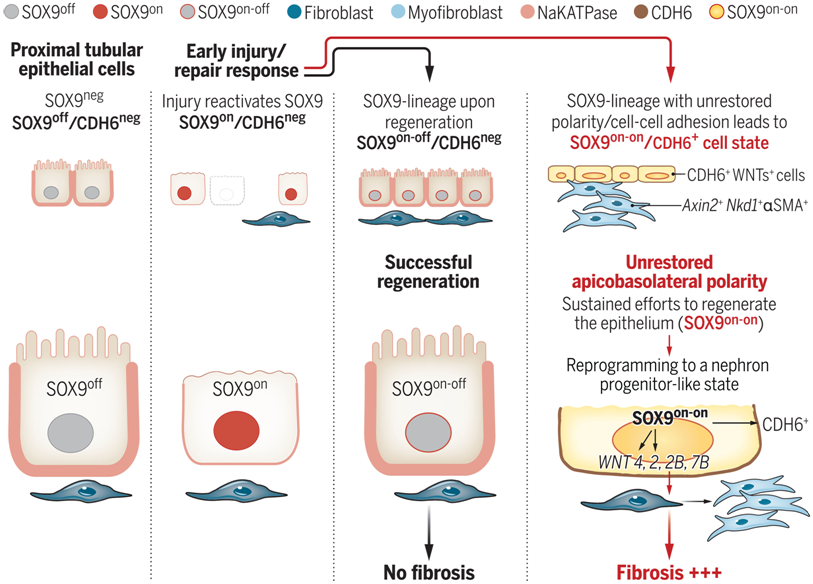
论文通讯作者、西达赛奈医学中心的Sanjeev Kumar 博士说,“这一发现的关键在于我们能够直接比较成功再生的受伤肾脏细胞和没有再生的肾脏细胞。受伤的肾脏细胞会激活一种名为SOX9的蛋白,以实现自我再生。痊愈后,它们会抑制这种蛋白。无法再生的肾脏细胞会让SOX9保持活性,这就导致了一种叫做纤维化的瘢痕。但当我们及时使 SOX9 失活时,这种瘢痕就会消失。”
Kumar说,肾脏负责过滤血液中的废物,糖尿病和高血压、COVID-19等严重感染以及过度使用抗生素和非甾体类消炎止痛药都会对肾脏造成伤害。
SOX9 蛋白在器官发育中起着重要作用,但在健康的成人肾脏中并不活跃。Kumar及其团队之前在另一项研究中发现,当肾脏受伤时,存活的肾脏细胞会重新激活 SOX9,这是愈合过程的一部分。
在这项新的研究中,Kumar团队对实验室小鼠的肾脏损伤进行了研究。他们在损伤处对单个肾脏细胞进行标记,然后跟踪这些细胞的后代随着时间的推移是如何进化的。
Kumar说,“在第10天,一些肾脏细胞的后代完全愈合,而另一些则没有。痊愈的肾脏细胞系关闭了SOX9的表达,而未痊愈的肾脏细胞系则继续试图完全再生,保持SOX9的活性。这就像一个传感器,当细胞想要再生时开启,当细胞恢复时关闭,我们是第一个发现这一点的人。”
此外,这些作者还发现,无法再生的肾脏细胞开始招募名为Wnts的蛋白,这是器官发育中的另一个关键角色。随着时间的推移,Wnts的积累会引发瘢痕。他们发现,在损伤一周后让SOX9失活可促进肾脏恢复。他们在瑞士和比利时合作机构的患者数据库中观察到了相同的过程。
Kumar说,“我们可以看到,到第7天时,移植肾脏开始缓慢发挥作用的人类患者也激活了SOX9。在我们合作者的数据库中,我们能够区分出,SOX9持续激活的患者比没有激活的患者肾功能更差,瘢痕更多。含有维持 SOX9活性的细胞的人体肾脏也富含 Wnts,并显示纤维化程度增加。”
Kumar说,这些发现为药物开发以及通过尿液诊断肾脏纤维化的非侵入性生物标志物的发现提供了靶标。目前,唯一可用的肾脏纤维化检测方法是活检,而活检有很多风险。
论文共同作者、西达赛奈医学中心医学系主任Paul Noble博士说,“阐明无瘢痕愈合与纤维化的机制几十年来一直困扰着科学界,其影响超出了肾脏,包括某些癌症。”
论文共同作者、西达赛奈医学中心理事会再生医学研究所执行主任 Clive Svendsen 博士说,这些发现还可能为患者带来新的治疗方案。Svendsen说,“这些发现有助于我们首次了解肾脏对损伤的反应有时是如何导致纤维化的。未来沿着这些方向开展的研究工作也能促进我们对心脏、肺部和肝脏纤维化的了解。”
成功的癌症免疫疗法涉及激活患者自身的 T 细胞,以识别肿瘤表面上称为抗原的特征性蛋白并对其进行攻击。但有些肿瘤有一个诀窍:它们通过阻止其抗原的显示来躲避免疫系统的攻击。在一项新的研究中,来自美国哈佛医学院等研究机构的研究人员在小鼠身上找到了绕过这种防御的方法。他们指出其中的关键在于一种名为prosaposin的蛋白。这些发现为开发附加疗法提供了一种策略,从而使癌症免疫疗法更加有效。相关研究结果近期发表在Science期刊上,论文标题为“Hyperglycosylation of prosaposin in tumor dendritic cells drives immune escape”。

肿瘤组织中含有大量垂死细胞,它们会脱落含有肿瘤抗原的小囊泡。称为树突细胞的免疫细胞会摄取这些囊泡,处理抗原,并在其表面呈递抗原碎片,从而教会T细胞识别和攻击这些抗原。
这些作者发现,如果没有prosaposin,树突细胞就无法分解囊泡,并将肿瘤抗原作为一种教学工具呈递给免疫系统。具体来说,他们发现树突细胞需要一种叫做saposins的蛋白,而saposins由prosaposin形成。论文通讯作者作者、波士顿儿童医院细胞与分子医学项目儿科副教授Florian Winau解释说,“我们发现,要消化这些囊泡并将肿瘤抗原释放出来以呈递给免疫系统,就需要saposins。”Winau及其同事们发现,肿瘤通过在prosaposin中加入糖分子链,使其抗原无法被免疫系统识别。这使得树突细胞分泌prosaposin,耗尽了它们的saposins供应。这样,树突细胞就无法消化囊泡,并释放出里面的肿瘤抗原。这些作者的下一步是尝试重新添加prosaposin。在皮肤癌黑色素瘤的小鼠模型中,他们给这些小鼠静脉注射了一种靶向树突细胞的抗体。这种疗法使得它们的免疫系统再次检测到肿瘤抗原并激活 T 细胞。当这些作者将prosaposin与免疫检查点抑制剂药物结合使用时,他们发现肿瘤生长有所减少。不过要确认基于prosaposin的治疗是否对人类有效,还需要进一步的研究。Winau及其同事们已经申请了这项技术的专利。他们与一家行业合作伙伴合作,设计了一种靶向系统来递送prosaposin,并希望开发出一种候选药物,在人体临床试验中进行测试。在另一个项目中,他们正在开发一种诊断测试,用于检测人体血液中糖分子链修饰的prosaposin。他们的目标指出当患者的肿瘤抗原呈递受损、肿瘤正在逃避免疫攻击时,需要改变治疗。
称为肺腺癌的肺部肿瘤有时会对最初有效的治疗方法产生反应,但是当它转变为更具侵袭性的小细胞肺癌(small cell lung cancer, SCLC)后,这种肺癌扩散迅速,几乎没有治疗选择。在一项新的研究中,来自美国威尔康奈尔医学院的研究人员开发了一种小鼠模型,揭示了这一有问题的过程,即所谓的组织学转变(histological transformation)。这些发现加深了人们对突变基因如何引发癌症进化的理解,并提出了更有效的治疗靶标。相关研究结果发表在2024年2月9日的Science期刊上,论文标题为“Lineage-specific intolerance to oncogenic drivers restricts histological transformation”。

在这项新的研究中,这些作者发现,在从肺腺癌向SCLC转变的过程中,突变细胞似乎通过一种类似干细胞的中间状态经历了细胞身份的改变,从而促进了这种转变。论文第一作者兼论文共同通讯作者、威尔康奈尔医学院的Eric Gardner博士说,“在人类患者身上研究这一过程非常困难。因此,我的目标是在小鼠模型中揭示肺腺癌向SCLC转变的内在机制。”这种复杂的小鼠模型耗时数年才培育出并表征,但却让他们破解了这一难题。论文共同通讯作者Harold Varmus博士说,“众所周知,癌细胞会不断进化,尤其是为了逃避有效治疗的压力。这项新研究表明,新技术(包括检测单个癌细胞的分子特征)与基于计算机的数据分析相结合,可以描绘出致命癌症进化过程中戏剧性的复杂事件,从而揭示出新的治疗靶标。”SCLC最常发生在重度吸烟者身上,但这种类型的肿瘤也发生在相当多的肺腺癌患者身上,尤其是在接受了靶向一种会促进肿瘤生长的叫做表皮生长因子受体(EGFR)的蛋白的药物治疗后。在转化后产生的SCLC型肿瘤对抗EGFR药物具有抗药性性,因为它们的生长是由一种新的癌症驱动因子---高水平的Myc蛋白---推动的。为了揭示这些癌症通路的相互作用,这些作者让小鼠患上了一种常见的肺腺癌,在这种癌症中,肺上皮细胞受EGFR基因突变的驱动。然后,他们把腺癌肿瘤变成了通常来自神经内分泌细胞的SCLC型肿瘤。为此,他们关闭了EGFR,同时还发生了其他一些变化,包括肿瘤抑制基因Rb1和Trp53的缺失,以及已知的SCLC驱动基因Myc的表达。

诸如EGFR和Myc之类的癌基因是通常控制细胞生长的基因的突变形式。它们在推动癌症生长和扩散方面的作用众所周知。另一方面,抑癌基因通常会抑制细胞增殖和肿瘤产生。令人惊讶的是,这项新的研究表明,癌基因的作用与环境有关。虽然大多数肺细胞对 Myc 的致癌作用有抵抗力,但神经内分泌细胞对 Myc 的致癌作用却非常敏感。相反,肺气囊的上皮细胞是肺腺癌的前体,它们在EGFR突变的作用下过度生长。论文共同通讯作者、威尔康奈尔医学院生理学与生物物理学助理教授Ashley Laughney博士说,“这表明,在错误的细胞类型中,‘癌基因’不再像癌基因那样起作用。因此,它从根本上改变了我们对癌基因的看法。”这些作者还发现了一种干细胞样中间状态,它既不是肺腺癌,也不是SCLC。只有当肿瘤抑制基因RB1和TP53发生突变时,处于这种中间状态的细胞才会变成神经内分泌性质的细胞。他们观察到,另一种名为 Pten 的肿瘤抑制因子的缺失加速了这一过程。在这一阶段,致癌性的Myc可驱动这些处于这种中间状态的干细胞样细胞形成SCLC型肿瘤。这项新的研究进一步支持了寻找针对Myc蛋白的药物的努力,因为Myc蛋白与多种癌症有牵连。这些作者如今计划利用他们的新小鼠模型进一步探索肺腺癌-SCLC转变过程,例如详细研究免疫系统如何正常应对这种转变。
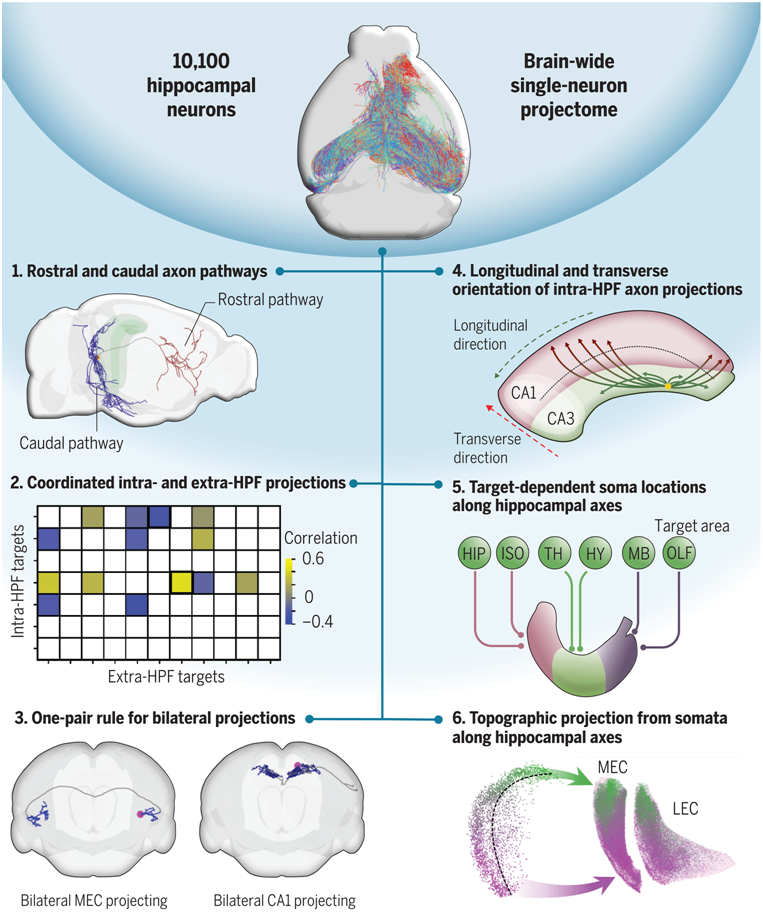
在一项新的研究中,来自中国科学院、华中科技大学苏州脑空间信息研究院、海南大学和临港实验室等研究机构的研究人员报告了一个由1万多个小鼠海马体神经元组成的单神经元投射组(single-neuron projectome)的综合数据库,从而揭示了小鼠海马体神经元在细观层次水平上的空间连接模式。相关研究结果发表在2024年2月2日的Science期刊上,论文标题为“Whole-brain spatial organization of hippocampal single-neuron projectomes”。

海马体是学习和记忆以及空间认知和情绪处理等多种大脑功能的重要大脑区域。它是研究最为广泛的大脑区域之一。海马体神经元向全脑目标广泛投射,因此在单神经元水平上研究海马体神经元的投射模式至关重要。这项新的研究以单细胞分辨率重建了小鼠海马体中1万多个神经元的全脑轴突形态,这些神经元的胞体覆盖了不同海马体轴线上的所有亚区和多个位置,是目前世界上最广泛的单神经元投射组数据库。这项新的研究采用创新方法:利用机器学习算法对轴突轨迹进行分类,从而更有效地分析了小鼠海马体神经元341种投射模式的形态相似性,最终确定了43种不同的投射组细胞类型。它还整合了小鼠 CA1 区域的空间转录组。基于这些分析,这项新的研究得以阐明海马体神经元沿前后轴的轴突投射途径,并揭示了海马体神经元的新投射模式。它还概述了海马体神经元胞体位置与投射目标之间的对应关系,揭示了双侧投射的基本组织原理。此外,通过对投射组细胞类型和空间转录组数据的相关性分析,这些作者发现了多个基因与投射组亚型之间的空间对应关系,为海马体功能提供了潜在的分子和回路靶标。总之,这项新的研究为今后研究海马体功能提供了结构基础,并揭示了海马体神经元的胞体位置、基因表达和回路功能之间的潜在对应关系。这个海马体单神经元投影组数据库以及海马体纵轴和空间转录组数据库如今已通过数字脑CEBSIT门户网站向公众开放。
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。
返回列表












 京公网安备 11011402010692号
京公网安备 11011402010692号




