在生物学中,清除东西可能与制造东西一样重要。细胞、蛋白或其他不再需要的分子的堆积会导致问题,因此生物已经进化出几种清理它们的方法。一个典型的例子是RNA外切体(exosome,注意是外切体,而不是外泌体,虽然这两者的英文单词都是一样的)。RNA分子在细胞中发挥许多作用。它们中的一些被翻译成蛋白;另一些形成了细胞的蛋白构建复合物。RNA外切体是一种细胞分子机器,可以降解有问题、有害或不再需要的RNA分子。如果没有这种微小的分子机器来修剪那些不能激发快乐的东西,我们的细胞将成为功能失调的囤积者,无法发挥作用。
纪念斯隆-凯特琳癌症中心结构生物学项目主席Christopher Lima博士解释说,“RNA监控和降解途径存在于所有的生命形式中。从细菌到人类,所有生物都有监测RNA质量和有目的地降解RNA的机制。”
Lima博士说,在很长一段时间里,这些途径被认为像家务劳动一样,有点无聊。但事实证明,这些降解途径受到高度监管,控制着从胚胎发育到细胞周期进展的一切。更重要的是,这些途径中的错误可以导致许多类型的疾病,从癌症到神经变性。
在一项新的研究中,Lima博士和Lima实验室博士后研究员M. Rhyan Puno提出了有助于解释RNA外切体如何定位需要被降解的RNA的研究结果。在低温电镜(cryo-EM)---一种先进的成像技术---的帮助下,他们能够破译一种名为人核外切体靶向(Nuclear Exosome Targeting, NEXT)复合物的蛋白组装体的结构,这种蛋白组装体是这种降解机制的一个关键部分。相关研究结果发表在2022年6月9日的Cell期刊上,论文标题为“Structural basis for RNA surveillance by the human nuclear exosome targeting (NEXT) complex”。
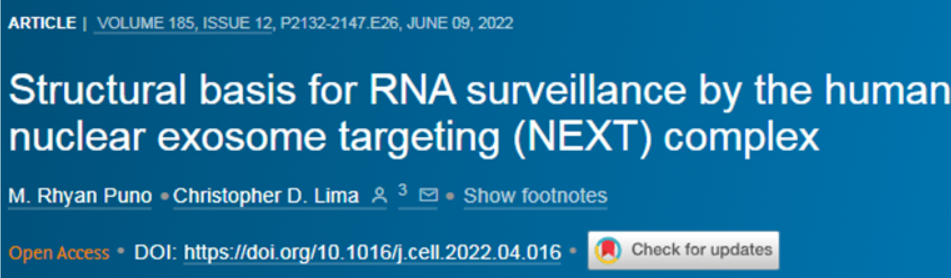
Puno博士说,“我们已知道NEXT复合物靶向递送RNA到RNA外切体,但从生化和结构上看,我们并不知道它是什么样子的,也不知道它是如何起作用的。”如今,通过低温电镜,他们获得了NEXT与RNA结合在一起的第一批清晰图片。这些图片,与伴随的生物化学和生物学实验一起,为RNA分子如何被递送给RNA外切体进行降解提供了新线索。几年前,Puno博士开始使用当时的金标准方法---X射线晶体学衍射---研究NEXT的结构。在这种方法中,首先将蛋白制成晶体,使其以相同的方式排列。然后,让X射线穿过晶体,击中探测器的X射线模式经解释后可确定蛋白的结构。虽然Puno博士能够将NEXT进行结晶,但由此产生的X射线衍射图片并不足以看到它的结构的细节。他说,“但后来出现了低温电镜革命。低温电镜帮助我们看到了NEXT的样子以及它如何结合它的RNA底物。”低温电镜的工作原理是捕捉冷冻但非结晶的蛋白样本的许多不同图像,然后使用计算方法将它们排列成最终的清晰图像。Lima博士说,“这几乎就像捕捉一只飞行中的鸟的一堆照片。因为有各种混乱的动作,鸟的翅膀可能看起来很模糊。但如果我们能在所有这些不同的照片中找到翅膀的部分,那么我们就能将这些照片对齐,以重建鸟类的翅膀是什么样子,并确定它们是如何起作用的。”从这些低温电镜图片中,他们能够看到NEXT蛋白形成了一种非常灵活的二聚体---这意味着NEXT蛋白的两个拷贝作为一个功能单元连接在一起。Puno博士说,“这真地非常、非常令人费解”。他指出,二聚体的形成在以前还没有对这些类型的蛋白进行过可视化观察。
他继续说,“从我们进行的生化实验中,我们知道二聚体化对降解有一定的重要性。但对我们来说,这种二聚体在引导RNA到RNA外切体中起什么作用仍然是个谜。”
为了帮助解开这个谜团,他们希望在降解过程的不同步骤中捕捉到NEXT复合物的相互作用,然后用低温电镜将这些构象进行可视化观察。这其中有很大的利害关系。RNA降解有多重要,从一长串因降解缺陷或控制不当而导致的疾病中可以看出。也许最有名的例子是囊性纤维化。在这种疾病中,编码一种在细胞膜上运送离子的蛋白的mRNA被RNA降解途径所降解。因此,这种蛋白不存在于肺部粘膜中,这导致那里的粘液堆积,并导致严重的呼吸障碍。Lima博士说,“这是RNA质量控制导致不良结果的一个著名例子。”但RNA降解途径的缺陷也在几种类型的癌症中起作用。事实上,在纪念斯隆-凯特琳癌症中心的基因测试平台MSK-IMPACT中检测到的两种基因突变是在与RNA外切体途径相关的基因---包括NEXT复合物中的一种蛋白---中发现的。Lima博士解释说,不仅是mRNA需要适当的质量控制。“现实是,如果你的RNA质量控制途径有缺陷,你的核糖体不工作,你的tRNA不工作,你的剪接体不工作。”这样的例子不胜枚举。RNA所执行的功能的广度解释了为什么有缺陷的RNA降解途径可以产生如此连环的致病影响。理解这些影响将需要更深入、更广泛地了解不仅是RNA外切体本身,而且还有帮助监视RNA并决定何时RNA有缺陷或不再需要的“上游”蛋白,比如NEXT。Lima博士说,“我们的梦想是启动RNA降解反应,将样本放入低温电镜中,并在它的工作过程中通过观察进行所有可能的确认。作为结构生物学家,我们希望能够看到实际的过程,然后能够重新组装它们。”
基于CRISPR技术的新型图谱将每个人类基因与其功能关联在一起
人类基因组计划(Human Genome Project)是一项雄心勃勃的举措,旨在对人类的每个DNA片段进行测序。该项目吸引了来自世界各地研究机构(包括怀特黑德研究所)的合作者,并最终于2003年完成。如今,二十多年过去了,怀特黑德研究所成员Jonathan Weissman及其同事们在一项新的研究中超越了人类基因组序列,首次全面地构建出人类细胞中表达的基因的功能图谱。相关研究结果于2022年6月9日在线发表在Cell期刊上,论文标题为“Mapping information-rich genotype-phenotype landscapes with genome-scale Perturb-seq”。他们将每个基因与它在细胞中的作用联系起来,这是多年来在单细胞测序方法Perturb-seq上合作的成果。
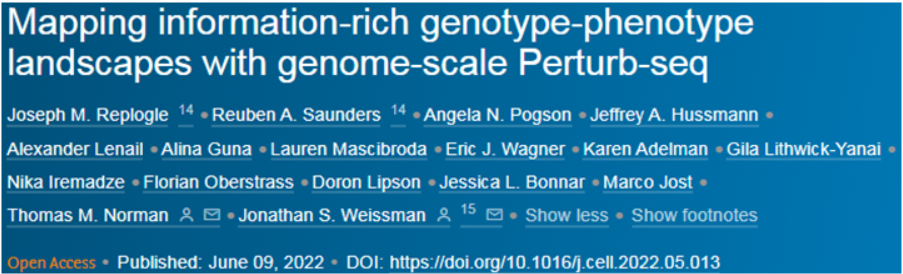
这些数据可以在Weissman实验室的网站上找到,供其他科学家使用。Weissman说,“这是一个大资源,就像人类基因组是一个大资源一样,你可以进去并进行基于发现的研究。与其提前确定你要研究的生物学,不如拥有这张基因型-表型关系图,你可以进去筛选这个数据库,而不必做任何实验。”这种筛选使得这些作者能够深入研究各种生物学问题。他们用它来探索功能未知的基因对细胞的影响,研究线粒体对应激的反应,并筛选出导致染色体丢失或增加的基因,一种在过去被证明很难研究的表型。论文共同通讯作者、前Weissman实验室博士后Tom Norman说,“我认为这个数据集将使那些来自生物学其他领域的人能够进行各种我们甚至还没有想到的分析,突然之间他们就有了可以利用的数据。”这项新的研究利用了Perturb-seq方法,该方法可以以前所未有的深度追踪开启或关闭基因的影响。该方法由包括Weissman和麻省理工学院教授Aviv Regev在内的一组研究人员于2016年首次发表,但只能用于小规模的基因集,且花费巨大(Cell, 2016, doi:10.1016/j.cell.2016.11.038)。论文共同第一作者、Weissman实验室医学博士生Joseph Replogle的基础研究工作使得大规模的Perturb-seq图谱成为可能。Replogle与Norman、Britt Adamson(普林斯顿大学分子生物学系助理教授)以及10x Genomics公司的一个小组合作,着手构建一个可以扩大规模的新版Perturb-seq。他们于2020年在Nature Biotechnology期刊上发表了一篇概念验证的论文(Nature Biotechnology, 2020, doi:10.1038/s41587-020-0470-y)。Perturb-seq方法使用CRISPR/Cas9基因组编辑将遗传变化引入细胞,然后使用单细胞RNA测序来捕获有关因特定遗传变化而表达的RNA的信息。因为RNA控制着细胞行为方式的所有方面,这种方法可以帮助破解遗传变化的许多细胞影响。自从他们最初的概念验证论文发表以来,Weissman、Regev和其他人已经在更小的范围内使用这种测序方法。例如,他们在2021年使用Perturb-seq来探索人类和病毒基因在感染HCMV(一种常见的疱疹病毒)的过程中如何相互作用(Nature Biotechnology, 2021, doi:10.1038/s41587-021-01059-3)。在这项新的研究中,Replogle和包括论文共同第一作者、Weissman实验室研究生Reuben Saunders在内的合作者,将这种方法扩大到整个基因组。他使用人类血癌细胞系以及来自视网膜的非癌细胞,对超过250万个细胞进行了Perturb-seq,并利用这些数据建立了一个将基因型和表型联系起来的全面图谱。在完成这种筛选后,这些作者决定将他们的新数据集投入使用,并研究一些生物学问题。Norman说,“Perturb-seq的优势在于它可以让你以无偏见的方式获得一个大数据集。没有人完全知道你能从这种数据集中得到什么限制。现在的问题是,你到底用它做什么?”第一个最明显的应用是研究具有未知功能的基因。鉴于这种筛选也读出了许多已知基因的表型,这些作者可以用这些数据来比较未知基因和已知基因,并寻找类似的转录结果,这可能表明这些基因产物作为一个更大的复合物的一部分一起发挥作用。一个名为C7orf26的基因的突变尤其引人注目。这些作者注意到,那些在移除后导致类似表型的基因是一种叫做Integrator的蛋白复合体的一部分,该复合体在产生小核 RNA方面起着作用。Integrator复合体由许多较小的亚基组成---以前的研究表明有14个单独的蛋白---他们能够确认C7orf26是该复合体的第15个组分。他们还发现,这15个亚基在较小的模块中一起发挥作用,在Integrator复合体中执行特定的功能。Saunders说,“如果没有这种高清晰的图谱,就不太清楚这些不同的模块在功能上是如此不同。”Perturb-seq的另一个好处是,由于这种检测方法专注于单细胞,这些作者可以利用这些数据来观察更复杂的表型,因为当它们与其他细胞的数据一起研究时,这些表型就会变得模糊不清。Weissman说,“我们经常把所有‘基因X’被敲除的细胞拿出来,对它们进行平均取值,看它们如何变化。但有时当你敲除一个基因时,失去同一基因的不同细胞会有不同的行为,而这种行为可能会被这种平均取值所忽略。”
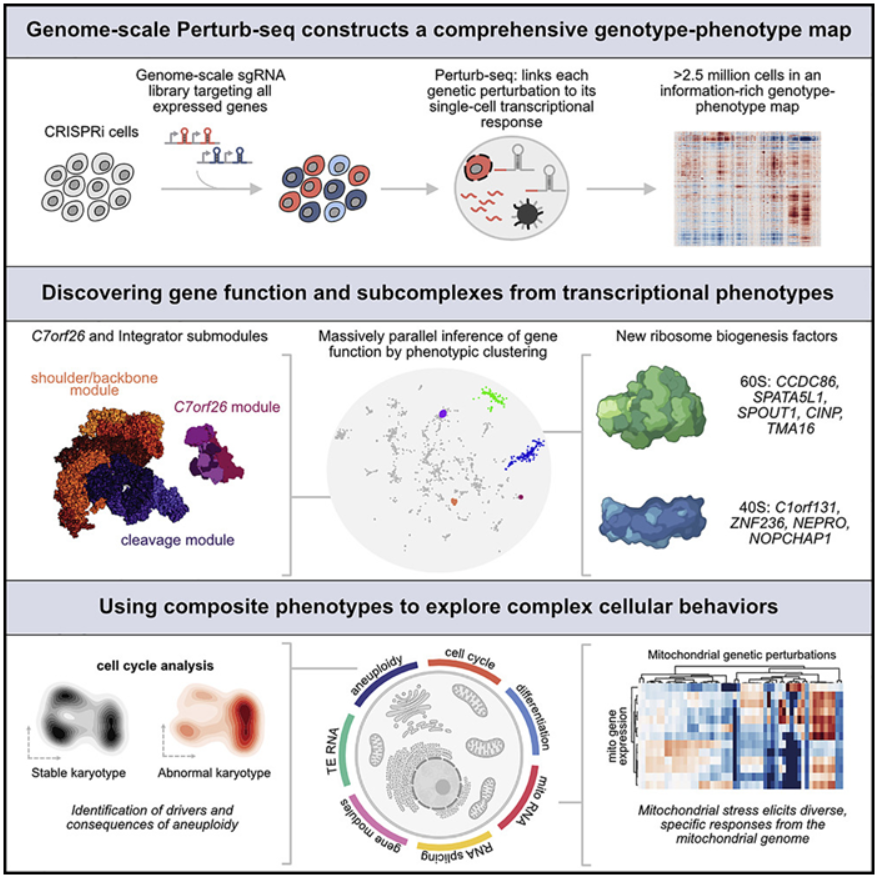
这些作者发现,在移除后在不同细胞中出现不同结果的一个基因子集负责染色体的分离。它们的移除导致细胞失去一条染色体或获得一条额外的染色体,这种情况被称为非整倍体。Weissman 说,“你无法预测失去这个基因的转录反应是什么,因为它取决于你获得或失去哪条染色体的次级效应。我们意识到,我们可以逆转这种情况,构建这种复合表型,寻找染色体获得和丢失的特征。通过这种方式,我们对正确分离DNA所需的因子进行了第一次全基因组筛选。”Norman说,“我认为这项非整倍体研究是迄今为止这些数据的最有趣的应用。它捕捉了一个你只能用单细胞读出的表型。你不能用其他方式去捕捉它。”这些作者还利用他们的数据集来研究线粒体如何对应激做出反应。从自由生活的细菌进化而来的线粒体在它的基因组中携带13个基因。在细胞核DNA内,大约有1000个基因与线粒体功能有某种程度的关系。Replogle说,“长期以来,人们一直对细胞核DNA和线粒体DNA在不同的细胞条件下如何协调和调控很感兴趣,尤其是当细胞遭受应激时。”这些作者发现,当他们干扰不同的线粒体相关基因时,细胞核基因组对许多不同的基因变化的反应是相似的。然而,线粒体基因组反应的变化要大得多。Replogle说,“线粒体为什么仍有自己的DNA,这仍然是一个悬而未决的问题。从我们的研究中得到的一个大的启示是,拥有独立的线粒体基因组的一个好处可能是对不同的应激源有局部的或非常特异的遗传调节作用。”Weissman说,“如果一个线粒体被破坏,而另一个线粒体以不同的方式被破坏,这些线粒体可能会有不同的反应。”在未来,这些作者希望将Perturb-seq用于他们开始使用的癌细胞系以外的不同类型的细胞。他们还希望继续探索他们的基因功能图谱,并希望其他人也能这样做。Norman说,“这确实是这些作者和其他合作者多年研究工作的结晶,我真地很高兴看到它继续成功和扩大。”
在一项新的研究中,来自荷兰阿姆斯特丹大学、美国杰克逊基因组医学实验室和哥伦比亚大学医学中心等研究机构的研究人员发现作为一种常见的大脑和脊髓肿瘤,浸润性胶质瘤(infiltrating glioma)是由其遗传进化和微环境决定的,这一发现可能导致更有针对性的治疗。相关研究结果发表在2022年6月9日的Cell期刊上,论文标题为“Glioma progression is shaped by genetic evolution and microenvironment interactions”。
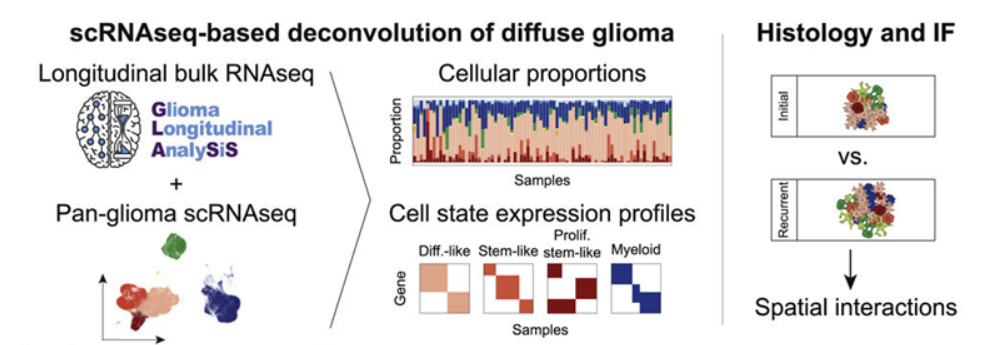
论文共同作者、科罗拉多大学癌症中心成员D.Ryan Ormond博士说,“我们确定了复发时的表观遗传学改变,这些改变不仅在某些病例中具有预后作用,而且可能导致针对不同亚型的不同治疗方案,从而改善长期生存。”这些作者观察了胶质瘤如何与大脑相互作用,随着时间的推移发生变化,产生治疗抵抗性并变得更具侵袭性。他们确定了胶质瘤复发时的三种不同表型,或者说可观察到的特征---神经元型、间充质型和增殖型。它们中的每一种都有细胞、遗传和组织学特征,这些特征在复发时会显现出来。其中一些特征与不太有利的结果有关。在这项新的研究中,这些作者使用了胶质瘤纵向分析联盟(Glioma Longitudinal Analysis Consortium, GLASS)的参与者样本,该联盟是为了确定胶质瘤治疗抵抗性的驱动因素而成立的。他们分析了来自304名患有异柠檬酸脱氢酶(IDH)野生型胶质瘤和IDH突变型胶质瘤的成年患者的肿瘤样本的RNA和/或DNA测序数据。肿瘤复发的方式取决于IDH突变状态。它们在复发过程中发生的变化取决于它们与它们所居住的微环境的相互作用方式。
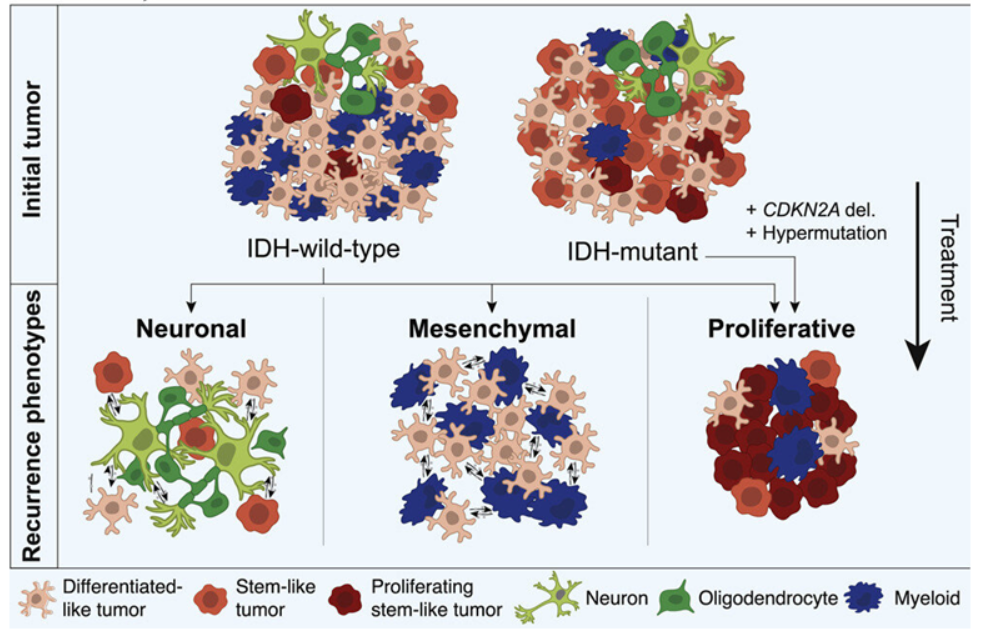
这些作者发现,许多IDH野生型胶质瘤在复发时更具侵入性。他们的肿瘤细胞显示出神经元信号程序的增加,这表明神经元的相互作用在引发这种肿瘤的进展中可能发挥了作用。他们还发现通常由替莫唑胺(temozolomide)等药物治疗诱发的高突变(hypermutation),以及产生肿瘤抑制蛋白的CDKN2A基因的缺失,与这两种胶质瘤亚型复发时肿瘤细胞的增殖有关。在IDH野生型和IDH突变型胶质瘤中,这种高突变与干细胞样肿瘤细胞(stem-like neoplastic cell)的数量增加有关。这些细胞的生长降低了患者的总体生存率。这些作者指出,“总的来说,这些结果表明,复发时的遗传进化可以改变胶质瘤细胞,使其朝着与预后不良有关的更多增殖表型发展。”Ormond说,“治疗抵抗性仍然是胶质瘤患者的一个严重障碍,为了提高生活质量和生存率,需要克服它。”他说,这些发现将使医生能够以新的药物和治疗方法更好地治疗这种癌症。
在一项新的针对小鼠的研究中,来自斯坦福大学医学院的研究人员发现一种利用患者自身的经过基因修饰的免疫细胞来攻击癌细胞的癌症治疗方法,当可以通过口服药物进行开启和关闭时,会更安全和更有效。相关研究结果发表在2022年5月12日的Cell期刊上,论文标题为“Enhanced safety and efficacy of protease-regulated CAR-T cell receptors”。

论文通讯作者、布莱根妇女医院神经病学系运动障碍科主任Vikram Khurana博士说,“我们的研究为α-突触核蛋白提供了新的见解,这种蛋白被认为是帕金森病和相关疾病产生的核心。目前的治疗方法靶向这种蛋白,但是它的功能一直不明确。传统上,α-突触核蛋白被认为在与细胞膜结合和称为囊泡的运输结构中发挥了作用。但我们的研究表明α-突触核蛋白有双重身份。”Khurana及其同事们的最初线索来自于α-突触核蛋白毒性的酵母和果蝇模型,并通过对人类细胞、患者衍生的神经元和人类遗传学的研究得到证实。他们发现α-突触核蛋白与囊泡相互作用的部分也与称为处理小体(processing body, P-body)的结构结合,其中P-body是细胞中通过信使RNA(mRNA)调节基因表达的分子机器。在由源自携带α-突触核蛋白基因突变的PD患者的诱导性多能干细胞产生的神经元中,P-body的生理结构和功能丧失,mRNA遭受异常调控。同样的情况也发生在来自患者死后大脑的组织样本中。人类基因分析支持了这些发现的疾病相关性:在P-body基因中积累突变的患者似乎有更高的PD风险。
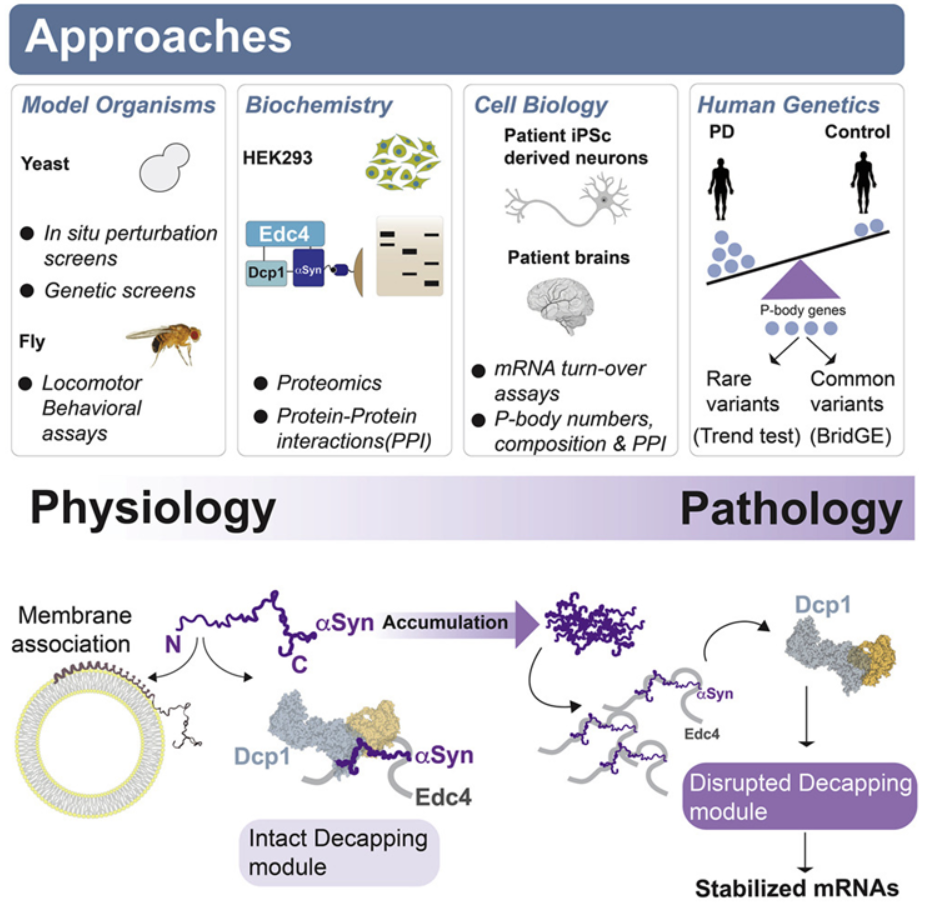
这些作者将α-突触核蛋白描述为一种“切换开关”,调节着两种非常不同的功能:囊泡运输和基因表达。在疾病状态下,这种平衡被打破。这些发现对PD治疗方法的开发有潜在的影响。他们指出,需要更清楚地了解哪些P-body组分可能是治疗干预的最佳靶标。正在进行的遗传学研究旨在确定哪些患者可能最适合这类干预,以及这种新发现的途径对PD患者的疾病风险和疾病进展的贡献有多大。论文第一作者、布莱根妇女医院神经病学系Erinc Hallacli博士说,“如果我们希望能够开发针对α-突触蛋白的治疗方法,那么我们需要了解这种蛋白的作用以及降低其水平或活性的潜在后果。这篇论文提供了重要信息,填补了我们对这种蛋白的知识空白,这可能有利于临床转化。”
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。
返回列表














 京公网安备 11011402010692号
京公网安备 11011402010692号




