在一项新的研究中,在大脑类器官的帮助下,来自奥地利科学院和维也纳医科大学等研究机构的研究人员能够确定结节性硬化症(tuberous sclerosis complex, TSC)是一种罕见的神经发育遗传性疾病,它是在发育过程中产生的,而不仅仅是在遗传上。通过这些来自患者的人类大脑实验室模型,他们将这种疾病的起源确定为人类特有的尾侧晚期中间神经元祖细胞(caudal late interneuron progenitor, CLIP)。这些研究结果进一步表明,只有使用人类衍生的大脑类器官模型才能很好地理解影响人类大脑的疾病的病理。相关研究结果发表在2022年1月28日的Science期刊上,论文标题为“Amplification of human interneuron progenitors promotes brain tumors and neurological defects”。 人类大脑的复杂性很大程度上是由于发育涉及到人类独有的过程,其中许多过程仍是我们当前科学知识中的空白。TSC在这方面也不例外,因为长期以来,基于动物模型获得的数据,它被描述为一种主要的遗传性疾病。如今,论文共同通讯作者、奥地利科学院分子生物技术研究所科学主任Jürgen A. Knoblich及其研究团队的突破性研究利用患者衍生的大脑类器官模型来揭开这种罕见的神经发育疾病的神秘面纱。Knoblich解释说,“我们对TSC根源的研究结果使我们发现了一种人类大脑特有的祖细胞类型。这解释了为什么其他实验室模型不能很好地确定这种疾病的病理。”
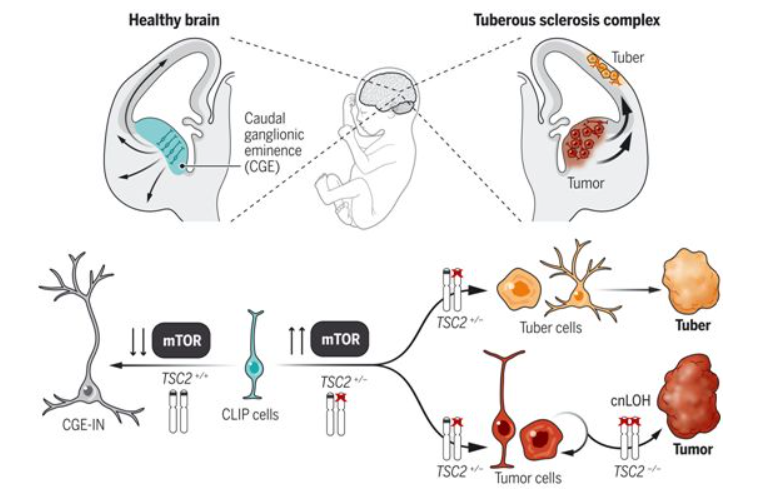
图为 在妊娠中期,尾侧神经节隆起中的CLIP细胞产生迁移到皮层的中间神经元
在许多受影响的患者中,TSC表现为严重的癫痫和精神症状,如自闭症和学习困难。从形态上看,TSC的特点是在患者的大脑中经常发现一些描述明确的迹象。其中,良性肿瘤存在于大脑的一个特定区域,以及大脑皮层中称为“结节(tuber)”的病变。长期以来,这两种形态上的畸变都被归结为遗传原因。然而,对患者样本的分析结果与流行的理论有分歧,主要是关于结节。论文共同通讯作者、奥地利科学院分子生物技术研究所Knoblich团队研究助理Nina Corsini解释说,“为了研究TSC,我们开发了这种疾病的大脑类器官模型:三维细胞培养物,我们用它来模拟大脑,我们可以获取源自任何一名患者的大脑类器官。”
在这项新的研究中,Knoblich团队培养出了源自几名受影响的患者的大脑类器官,这种方法可以研究患者大脑在发育过程中某个阶段存在的分子和细胞机制。论文第一作者Oliver Eichmüller解释说,“通过这种方法,我们发现,就像在患者的大脑中一样,这类大脑类器官长出了肿瘤,并有类似于患者结节的无序区域。”
然而,重现一种疾病的病理生理学特征仅仅是第一步。Eichmüller说,“通过进一步挖掘原因,我们发现这两种异常都是由人类大脑特有的一种细胞类型过度增殖引发的。这些细胞被称为尾侧晚期中间神经元祖细胞,简称CLIP细胞。它们在人类大脑的发育阶段被发现,但在像小鼠这样的动物中没有。”Corsini说,“我们的研究表明,我们的大脑非常复杂,比大多数动物的大脑要复杂得多。”
Knoblich团队不仅将TSC与其他神经发育和神经精神疾病相提并论,而且也将它与影响人类大脑的恶性疾病相提并论,推测这些疾病也可能是由人类特有的发育过程引起的。Knoblich说,“我们在大脑发育和病理方面的人类特有原理的发现也可能适用于迄今为止还没有治疗方法的其他已知疾病。”
2013年因在奥地利科学院分子生物技术研究所建立人类大脑类器官而成为全球头条新闻,Knoblich实验室已将这种技术用于研究人类大脑发育的隐藏过程,以及影响人类大脑的几种疾病。凭借他们目前的发现,Knoblich团队如今能够揭示出神经科学和医学方面的一个未解之谜。Knoblich说,“我们显然不会止步于此。作为下一步,我们旨在通过进一步调整我们的技术来研究更多的神经精神疾病。我们相信,这种人类衍生的实验室模型将最终帮助我们确定长期以来一直被忽视的人类特有机制。”
在一项新的研究中,来自中国科学院生物化学与细胞生物学研究所、上海科技大学和苏州大学的研究人员开发出麦角酸二乙基酰胺(LSD)和裸盖菇素(psilocybin)的非致幻类似物,有可能用于治疗精神疾病。相关研究结果发表在2022年1月28日的Science期刊上,论文标题为“Structure-based discovery of nonhallucinogenic psychedelic analogs”。在这篇论文中,他们描述了他们构建出的类似物以及它们在小鼠身上的表现。 近年来,科学家们发现一些致幻剂,如LSD和裸盖菇素,可以为患有慢性抑郁症和其他精神疾病(如创伤后应激障碍)的患者提供缓解。尽管许多患者可能喜欢致幻体验,但许多人却不喜欢。因此,科学家们一直在仔细研究致幻剂,以找到为抑郁症患者提供缓解的机制---如果可能的话,确定这类药物的致幻作用对治疗是否必要。
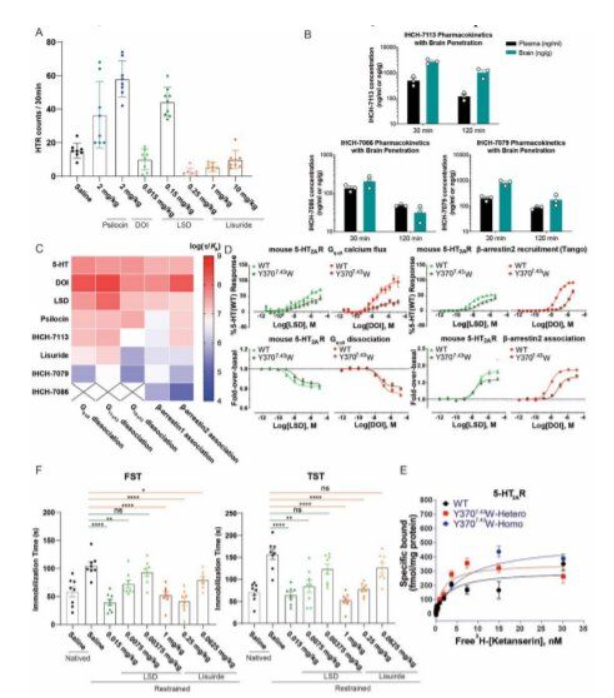
图为 迷幻剂对幻觉和抑郁相关动物行为的影响
在这项新的研究中,这些作者使用X射线晶体学仔细观察了LSD和裸盖菇素,并能够确定它们与神经受体5-HT2AR结合时的构象。他们发现这两种分子都能以两种方式与5-HT2AR结合,从而形成独特的构象。他们随后构建出能以他们发现的第二种结合方式与5-HT2AR结合的化合物。
这些作者给小鼠注射了这些化合物,其中这些小鼠被悬尾或被迫长时间游泳,遭受的压力达到了抑郁的地步。为了测试这些小鼠是否经历了致幻作用,他们使用了抽搐测试。先前的研究已表明,当小鼠被给予致幻剂时,它们的头部会以一种独特的方式抽搐。为了测试抑郁症的症状是否缓解,他们观察了测试的小鼠是否从事它们在抑郁症发生时停止的活动。他们发现这些小鼠的头部没有抽动,而且对正常活动重新产生了兴趣。他们表示,他们的研究工作代表了开发普通致幻药物的非致幻类似物的一个良好起点。
在一项新的研究中,来自美国西北大学等研究机构的研究人员发现体内的蛋白家族有可能预测哪些患者有可能会排斥新移植的器官,从而帮助患者做出治疗决定。这一进展标志着对特定细胞中的蛋白进行更精确研究的新时代的开始。相关研究结果发表在2022年1月28日的Science期刊上,论文标题为“The Blood Proteoform Atlas: A reference map of proteoforms in human hematopoietic cells”。 科学家们倾向于观察蛋白的变化模式,就像在水下看护目镜一样,仅获取关于它们的独特结构的一小部分可用信息。但是,在这项新的研究中,这些作者用放大镜观察这些相同的结构,并构建出一种清晰的蛋白家族图谱:血液蛋白形态图谱(Blood Proteoform Atlas, BPA)。他们随后在肝脏移植受者中构建出这种蛋白家族图谱,发现免疫细胞蛋白中的新指标随着排斥反应而改变。 这种BPA图谱概述了超过56000种确切的蛋白分子(称为蛋白形态),因为它们出现在21种不同的细胞类型中---这些结构比以前类似的研究中出现的几乎多10倍。 触及表面 论文共同通讯作者、西北大学蛋白质组学权威专家Neil Kelleher说,“我们正在努力构建相当于人类基因组计划的蛋白图谱。BPA是其中的一个缩影。”
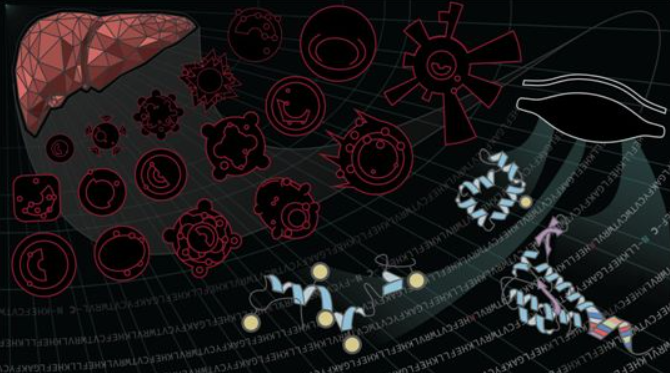
Kelleher实验室使用最先进的质谱技术和数据分析来有效地识别细胞和血液中的蛋白形态,以一种“自上而下”的分析形式保持蛋白形态的完整性,而不是像行业标准那样把它们切成小片段。他说,“我们开始观察到复杂性。在这篇论文中,我们展示了患者、细胞类型和蛋白形态特异性的测量,这使我们能够获得更好的生物标志物。”
肝移植排斥反应的血液测试
拥有跨学科的团队成员,可以让项目概念化地从实验室走向临床。当Kelleher探究细胞内现象的科学基础时,论文共同通讯作者、西北医学大学移植肝病学者Josh Levitsky与他合作,了解如何将这些生物标志物应用于特定的系统。
Levitsky最初是通过他在生物标志物领域的领先地位与Kelleher联系在一起。在生物标志物领域,血液中的可测量标志被用来预测患有某种疾病的患者的健康指标,就这项研究而言,指的是肝脏移植排斥反应。
Levitsky说,“对Kelleher来说,有一个生物相关的例子来说明这些蛋白形态如何能作为标志物非侵入性地识别疾病,这一点真的很重要。而且在我的领域也需要有与他们的免疫生物途径更相关的机制上的生物标志物。这可能是细胞特异性标志物的新时代的开始。”
医生必须用药物治疗来抑制免疫系统,并监测肝脏移植受者的排斥迹象,往往在排斥反应发作后才作出反应。通过对最细微的层面上发生的事情的具体了解,可以消除整个过程中的猜测。
有了BPA图谱作为参考图,这些作者从Levitsky的一项生物标志物收集研究中的参与者那里提取了血液样本。他们检查了哪些蛋白形态似乎在对肝脏移植作出排斥反应时被激活,并确定了那些与没有发生肝脏移植排斥反应的患者相比发生变化的蛋白形态。
接下来,这些作者从最初的研究中筛选出一组由24种蛋白形态组成的蛋白形态,并在美国全国各地的肝脏移植受者样本中观察它们。他们发现同样的蛋白形态在第一次临床试验中显示出来。
推动该领域的发展
Levitsky说,“我们的希望是能够利用这组蛋白形态来识别那些没有排斥迹象的患者和那些有早期排斥迹象的患者。如果我们能在排斥反应发生前几周注意到这一点,我们可能就能对免疫抑制加以调整。”
Levitsky继续研究移植受者的蛋白形态如何随时间变化,以开发更多的生物标志物,从而为他如何治疗患者提供参考。Kelleher说,随着BPA图谱中细胞类型的增加,使用它的潜在方法也会增加。除了扩大对人类生物学的理解外,BPA图谱还可能在各种免疫性疾病中得到类似的应用。
在一项新的研究中,来自瑞典乌普萨拉大学的研究人员展示了DNA结合蛋白如何在不受到阻碍的情况下在整个基因组中搜索它的靶序列。这一结果与我们目前对基因调控的理解------遗传密码影响DNA结合蛋白的结合频率,但不影响它的结合时间---相矛盾。相关研究结果发表在2022年1月28日的Science期刊上,论文标题为“Sequence specificity in DNA binding is mainly governed by association”。 在有机体的一生中,它的基因组变化很小。不断变化的是细胞在应对损伤、环境变化或生殖周期不同阶段时产生哪些蛋白。蛋白的产生是由DNA结合蛋白调节的,这些蛋白已经进化出开启或关闭不同基因的能力。由于环境可以迅速变化,快速适应是关键。DNA结合蛋白必须在数以百万计的碱基对中找到正确的DNA代码,而且要快。 当DNA结合蛋白在遗传密码中寻找它们的靶序列时,它们沿着DNA螺旋滑动以加快这一过程。当它们最终找到正确的位置时,它们停留在那里;与“正确的”靶序列的相互作用阻止了它们的滑行。这一机制已被广泛接受来描述这一搜索过程。这确是一个吸引人的假说,但它提出了一个恼人的问题---DNA代码中充满了许多“几乎正确”的序列。如果DNA结合蛋白在特定的DNA基序上停留的时间是由序列决定的,那么执行搜索任务的DNA结合蛋白将不断地在与它们的靶序列相似的序列上逗留。
多稳定性(multistability)允许基因相同的细胞存在数千种分子不同和有丝分裂稳定的状态。构建合成的多稳定回路可以深入了解足以实现多稳定性的最小回路,并为在工程化细胞疗法中利用多细胞性建立基础。然而,针对哺乳动物细胞的研究工作仅限于双状态系统,或使用了不能轻易扩展的架构。除了产生长期的多稳定性,一种理想的合成架构还应重现天然细胞命运控制系统的关键特性,包括用瞬时的外部输入让细胞在不同状态之间切换的能力、控制特定状态的稳定性的能力,以及产生不可逆的状态转换的能力。尽管在确定许多天然细胞命运控制系统中的关键基因和调节相互作用方面开展了大量研究工作,但是仍不清楚哪些回路架构可以提供这些能力。 天然细胞命运控制系统表现出两种普遍的特征:积极的自动调节和组合性的蛋白-蛋白相互作用。在一项新的研究中,来自美国加州理工学院的研究人员根据类似的原则设计出一种称为MultiFate的最小回路架构,在这种架构中,一组转录因子竞争性地形成同源二聚体和异源二聚体,只有同源二聚体才能激活它们自身基因的表达。相关研究结果发表在2022年1月21日的Science期刊上,论文标题为“Synthetic multistability in mammalian cells”。 数学建模表明,MultiFate可以产生不同类型的多稳定性,支持可受到控制的状态切换,并实现不可逆的状态转换。至关重要的是,利用异源二聚体实现交叉抑制使得MultiFate可以通过添加新的转录因子扩展到更多的状态,而不需要重新设计现有的组分。这些特性表明,MultiFate可以为多稳定性提供一种理想的合成架构。
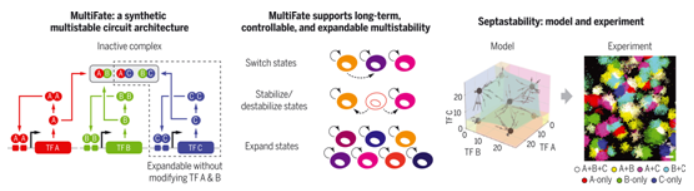
图为 MultiFate支持长期、可控和可扩展的多稳定性
为了构建MultiFate回路,这些作者首先设计了一套锌指转录因子,使得同源二聚体依赖的自激活和异源二聚体依赖的抑制成为可能。他们随后构建出一种称为MultiFate-2(由两种锌指转录因子组成)的最小回路,将它稳定地整合到CHO-K1细胞中,并获得了几种单克隆的MultiFate-2细胞系。流式细胞分析和延时成像显示,MultiFate-2细胞能够以三种不同的表达状态存在:主要表达一种锌指转录因子、主要要表达另一种锌指转录因子和主要要表达这两种锌指转录因子。这些状态中的每一种都能在数周或更长时间内保持稳定。通过使用外部诱导剂,他们能够让细胞在这些不同的状态中切换。最后,与模型预测一致,减少蛋白稳定性导致了三状态到双状态的分叉,选择性地破坏了表达两种锌指转录因子的状态,同时保留了表达单个锌指转录因子的状态。即使恢复了蛋白的稳定性,退出不稳定状态的细胞也不会返回,这重现了在许多天然命运控制系统中观察到的不可逆转的状态转换。
为了测试MultiFate设计的可扩展性,这些作者将第三种转录因子整合到MultiFate-2细胞系中。正如这种模型所预测的那样,所产生的MultiFate-2细胞可以在七种不同的状态下稳定存在18天以上。逐步降低蛋白的稳定性,使得这种系统从七状态(septastability)到六状态(hexastability)再到三状态(tristability)的反复分叉,从而进一步重现了天然细胞分化系统中细胞命运潜力的逐步丧失。建模表明MultiFate系统应该可以扩展到三种转录因子以上,以产生数百种健壮的稳定状态。
近期,单细胞转录组方法揭示了天然细胞状态的惊人多样性,使得如何产生和控制这种多稳定性的问题比以往任何时候都更加紧迫。MultiFate展示了一种相对简单的、受自然启发的架构如何能产生天然多稳定性的几种特征:它们通过转录因子的组合产生长期的多稳定性;它们允许使用外部诱导剂进行可受到控制的状态切换;它们允许对状态稳定性进行调节,这使得分层和不可逆的细胞转换成为可能。由于MultiFate可以随时扩展,通过添加新的转录因子产生更多的状态,它为探索多稳定性的回路级原理提供了一个可扩展的基础,并使合成生物学中的多细胞应用成为可能。
多发性硬化症(MS)是一种影响全球280万人的渐进性疾病,目前尚无明确的治疗方法。在一项新的研究中,来自美国哈佛大学陈曾熙公共卫生学院的研究人员发现多发性硬化症可能是由爱泼斯坦-巴尔病毒(EBV, 也称为EB病毒)感染引起的。他们的研究结果于2022年1月12日在线发表在Science期刊上,论文标题为“Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis”。 论文通讯作者、哈佛大学陈曾熙公共卫生学院流行病学与营养学教授Alberto Ascherio说,“我们团队和其他人对EBV导致多发性硬化症的假设已经研究了好几年,但这是第一个提供令人信服的因果关系证据的研究。这是一大进展,因为它表明大多数多发性硬化症病例可以通过阻止EBV感染来预防,并且靶向EBV可能导致发现治愈多发性硬化症的方法。”
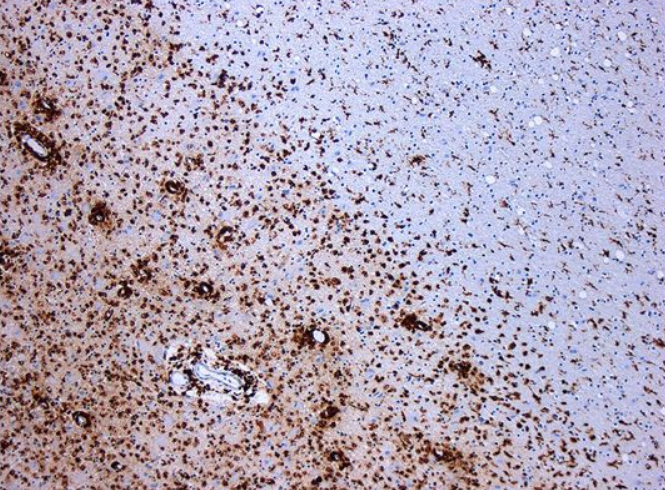
图为 多发性硬化症导致神经元脱髓鞘。CD68染色组织显示病变区域有多个巨噬细胞
多发性硬化症是一种中枢神经系统的慢性炎症性疾病,它攻击保护大脑和脊髓中神经元的髓鞘。它的病因尚不清楚,然而,最大的嫌疑对象之一是EBV,即一种能引起传染性单核细胞增多症的疱疹病毒,它在宿主身上建立一种潜伏的、终身的感染。在这种病毒和多发性硬化症之间建立因果关系一直很困难,因为EBV感染了大约95%的成年人,多发性硬化症是一种相对罕见的疾病,而且多发性硬化症症状的出现是在EBV感染大约十年后开始的。为了确定EBV和多发性硬化症之间的联系,这些作者在美国军队现役的1000多万年轻成年人中进行了一项研究,并确定了955人在服役期间经诊断患有多发性硬化症。
这些作者分析了美国军队每两年采集的血清样本,并确定了士兵在第一次取样时的EBV状态以及EBV感染与服役期间多发性硬化症发病之间的关系。在这个队列中,感染EBV后多发性硬化症的风险增加了32倍,但感染其他病毒后则没有变化。神经丝轻链(neurofilament light chain)是多发性硬化症中典型的神经变性的生物标志物,它的血清水平仅在感染EBV后增加。这些发现不能用任何已知的多发性硬化症风险因素来解释,这提示着EBV是导致多发性硬化症的主要原因。
Ascherio说,EBV感染和多发性硬化症发病的延迟可能部分上是由于这种疾病的症状在最早阶段没有被发现,部分上是由于EBV和宿主的免疫系统之间的进化关系,毕竟每当潜伏的EBV重新激活时,宿主的免疫系统就会受到反复的刺激。
Ascherio说,“目前没有办法有效地预防或治疗EBV感染,但EBV疫苗或用EBV特异性抗病毒药物靶向这种病毒最终可以预防或治愈多发性硬化症。”
作为一家全球医疗技术公司,BD公司(Becton, Dickinson and Company)宣布,与欧洲分子生物学实验室(EMBL)合作进行的一项研究,作Science期刊最新一期的封面故事发表,介绍了BD公司在流式细胞仪方面的一项新创新,它增加了荧光成像和基于图像的决策,根据每个细胞的视觉细节而不是仅仅根据存在的生物标志物的类型或数量,以极高的速度对单个细胞进行分类。这项新技术有可能改变免疫学、细胞生物学和基因组学研究,并实现新的基于细胞的治疗发现。相关研究结果发表在2022年1月21日的Science期刊上,论文标题为“High-speed fluorescence image–enabled cell sorting”。 通过流式细胞仪进行的细胞分选可使科学家们能够根据每个细胞的具体特征来识别和分选单个细胞,以便更详细地研究它们,评估每个细胞可能对一种新药物的反应,或进行其他单细胞实验。传统上,细胞分选仪器通过识别和定量确定细胞表面上或细胞内部的某些生物标志物(如蛋白质)来运作。BD公司的这项新创新,即BD CellView图像技术,能以每秒15000个细胞的速度捕捉流经这种系统的单个细胞的多幅图像,还增加了以前不可能实现的能力,即以这种速度根据单个细胞的详细显微镜图像分析来分选细胞。 通过在传统的生物标志物识别和定量确定中加入成像技术,这种新技术不仅能识别细胞中是否存在某种生物标志物以及存在多少,还能识别其位置或在细胞中的分布情况。通过用这种技术对生物标志物的分布进行成像,这些作者获得了以前在传统流式细胞仪实验中看不到的关于细胞的详细信息,这使他们能够回答复杂的生物学问题,如细胞如何生长、发挥功能和相互作用,或研究病毒或蛋白在细胞内的确切位置,所有这些都是以高度加快的速度进行的。
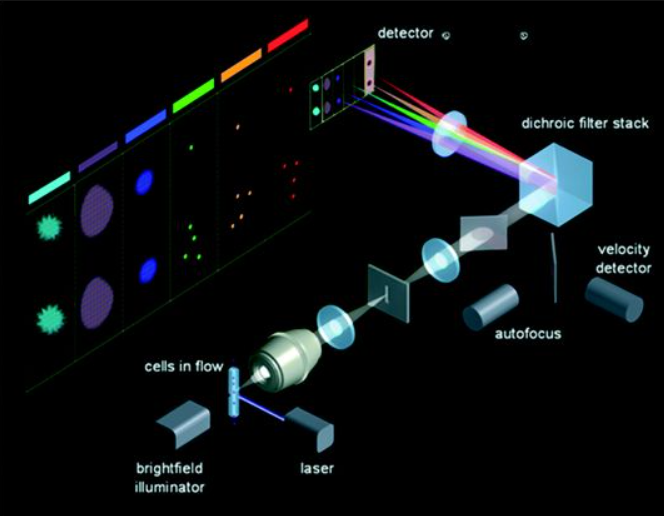
图为 ImageStream的光学器件
BD公司董事长、首席执行官兼总裁Tom Polen说,“这种创新克服了对单个细胞进行分选的速度和精度之间的典型折衷。这一突破实质上相当于科学家们在显微镜下观察,识别感兴趣的细胞的具体特征,并根据他们所看到的,对每个单个细胞进行分选,以便进一步分析---所有这些都以每分钟近100万个细胞的速度进行。与传统的流式细胞仪方法相比,该技术可以分析1000多倍的数据量,并根据图像以每秒15000个的速度对细胞进行分选。BD公司是20世纪70年代第一家将流式细胞仪技术商业化的公司,这也是我们在这一领域创新和技术领先的传奇历史的又一个例子。”
这项新技术填补了生物医学研究的长期空白,使科学家们能够更迅速地查看和分离具有特定的、可观察到的感兴趣的特征的细胞,这可以加速发现研究,并在病毒学和肿瘤学等广泛的领域发掘潜在的治疗方法或治愈疾病的方法。
论文共同通讯作者、BD公司全球研发副总裁Eric Diebold说,“这项技术代表了一个由光学、机械、电子、生物医学和软件工程师及科学家组成的高度多学科团队十多年来的工作成果,旨在为科学家们提供分析单细胞的差异化和灵活的能力。我们只是触及了这种新的基于图像的高通量细胞分选技术所能实现的科学类型的表面,我们期待着BD公司和广大科学界将如何利用它来推动基础研究和治疗方法的开发。”
这项研究的细节
在这项新的研究中,这些作者利用BD CellView图像技术研究了NF-κB途径的调节因子,其中NF-κB在细胞免疫和应激反应中发挥着重要作用。他们通过追踪RelA的位置来测量这一途径的活性,其中RelA是一种在激活时从细胞质移入细胞核的蛋白。利用BD CellView图像技术,他们能够在几个小时内确定这一重要细胞途径的几种新的调节因子,而不是像使用传统方法那样需要几天。这一结果对加快基因组研究和治疗发现的步伐具有广泛的意义。
论文共同通讯作者、斯坦福大学遗传学教授Lars Steinmetz博士说,“多年来,科学家们一直希望有一种允许他们详细了解细胞的内部运作情况并分离出那些具有感兴趣的微观表型的细胞筛选系统。这就是BD CellView图像技术所实现的,从而确定了细胞分离和表征的一个新标准。我们很高兴将这项技术应用于高分辨率的基因组筛选,旨在收集基因组每个部分的功能信息。我们还在探索基于细胞的诊断和健康与疾病中的细胞表征方面的应用。”
在一项新的研究中,来自美国拉霍亚免疫学研究所的研究人员发现动脉中的免疫细胞可以“嗅”出它们周围的环境并引起炎症。相关研究结果发表在2022年1月14日的Science期刊上,论文标题为“Olfactory receptor 2 in vascular macrophages drives atherosclerosis by NLRP3-dependent IL-1 production”。 论文通讯作者、拉霍亚免疫学研究所的Klaus Ley教授说,“有气味的分子可以促进炎症。” 这项新的研究表明这种炎症会导致小鼠的心血管疾病和动脉粥样硬化。这些作者通过阻断称为巨噬细胞的免疫细胞对一种叫做辛醛(octanal)的化合物的感应来逆转这种炎症。 每个人的血液中都有少量的辛醛,但是这些作者发现具有心血管疾病标志物(比如较高的LDL胆固醇)的人也有较高的辛醛水平。这种额外的辛醛可能由于饮食或细胞中一种叫做氧化应激的现象而最终进入血液。 人类的鼻子已经善于闻到辛醛。Ley将辛醛的味道描述为一种热过的鸡肉的气味。他说,“就像不再那么好闻的鸡肉。” 2019年,由拉霍亚免疫学研究所科学助理Sara McArdle博士带头的一项研究已首次表明血管壁中的巨噬细胞也有一些“嗅出”分子所需的嗅觉受体(Circulation Research, 2019, doi:10.1161/CIRCRESAHA.119.315175)。2020年,拉霍亚免疫学研究所的科学家们首次报告说这些巨噬细胞能够感知辛醛,这要归功于一种叫做OR6A2的嗅觉受体(Journal of Immunology, 2000, 论文链接:https://www.jimmunol.org/content/204/1_Supplement/68.22)。
论文第一作者、拉霍亚免疫学研究所讲师Marco Orecchioni博士说,“巨噬细胞是我们免疫系统中最重要的一些细胞。它们在不断地检查信号。我们可以说它们在‘闻’它们的环境并作出反应。”这项新的研究是首次精确地显示了嗅出辛醛如何能促进动脉中的炎症。
Orecchioni测试了给正常的“野生型”小鼠和剔除小鼠巨噬细胞受体Olfr2(相当于人类的OR6A2)基因的小鼠注射辛醛的效果。通过比较这些小鼠群体,Orecchioni发现,当Olfr2受体感觉到辛醛时,炎症会变得更加严重。随着时间的推移,动脉甚至开始出现动脉粥样硬化中看到的病变。
这些作者随后使用了一种叫做柠檬醛(citral, 具有类似柠檬的气味)的分子,已知它能阻断这种小鼠嗅觉受体,并观察到炎症下降。通过使巨噬细胞对辛醛失明,他们逆转了它们的疾病进展。
Ley和Orecchioni认为也有可能在人类中阻断属于G蛋白偶联受体(GPCR)的OR6A2。Ley说,“这些受体是非常有名的药物靶标。事实上,今天市场上的大多数药物都作用于这种类型的称为GPCR的受体。”
这些作者如今正在研究在巨噬细胞表面上发现的其他嗅觉受体的作用。他们还在研究OR6A2在人类中如何起作用。
Orecchioni计划继续研究动脉粥样硬化,但他很好奇嗅觉受体是否可能在2型糖尿病等代谢性疾病中发挥作用。他说,“这项研究只是新事物的第一个暗示。它为我们未来多年的研究开辟了道路。”
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




