在细胞分裂过程中,新的子细胞会从母细胞那里继承遗传物质和其他分子的混合物。这种遗传既包括有益的成分,可以帮助它们在生命中有一个强健的开端,也包括潜在的有害突变或受损分子,给新生的子细胞带来巨大挑战。
子细胞如何控制和减轻有害遗传的影响一直是个谜。在一项新的研究中,来自德国马克斯-普朗克免疫生物学与表观遗传学研究所的研究人员揭示了一种复杂的机制,通过这种机制,子细胞可以保护自己免受从母细胞遗传而来的受紫外线破坏的RNA的伤害。相关研究结果于2024年3月18日在线发表在Cell期刊上,论文标题为“RNA damage compartmentalization by DHX9 stress granules”。

当太阳光照射到我们的皮肤上时,会给我们带来温暖和活力。然而,在这温柔的怀抱下却隐藏着潜在的威胁:紫外线(UV)照射,阳光中能量最高的成分。虽然我们都知道紫外线会破坏 DNA 并导致皮肤癌,但它对另一种重要分子——RNA的影响却往往不被人注意。
在测试细胞对多种应激源的反应时,这些作者注意到了一些耐人寻味的现象:紫外线照射后,一种名为DHX9的蛋白在细胞质内聚集成液滴结构。
论文通讯作者、马克斯-普朗克免疫生物学与表观遗传学研究所主任Asifa Akhtar说,“DHX9是一种通常位于细胞核内的酶,具有结合RNA的能力。发现这种蛋白在细胞核外形成液滴让我们非常惊讶。这就像在沙漠中发现了一个巨大的雪球。”
揭开 DHX9 颗粒的神秘面纱
众所周知,紫外线辐射会造成 DNA 损伤,因此这些作者最初猜测这些 DHX9 颗粒是防止这种损伤的防御机制。
论文第一作者Yilong Zhou说,“与这一假设相反,我们发现多种形式的DNA损伤刺激并未触发DHX9颗粒。这促使我们去探究真正的触发因素。”因此,他们开发了一种突破性的液滴提取方法,直接从细胞中分离出这些颗粒并分析其含量。令人惊讶的是,他们发现,作为应激颗粒的一种特殊类型,DHX9颗粒中含有受损的RNA。
Akhtar解释说,“紫外线对 RNA 的破坏作用常常被低估,它对DNA的影响也掩盖了这一点。如今,我们发现了一种优雅的机制:细胞可以在DHX9颗粒的帮助下分离和中和受到有害的紫外线破坏的RNA。”
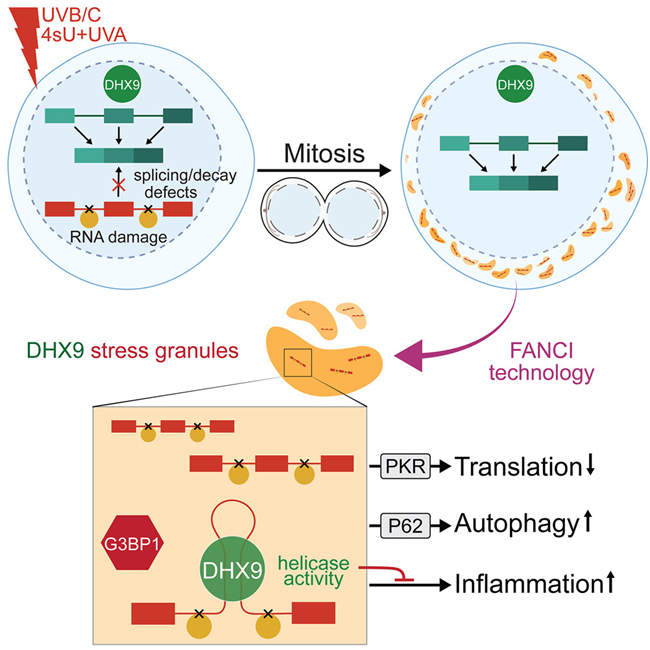
当细胞检测到紫外线照射引起的 RNA 损伤时,它们会迅速将受损分子捕获到 DHX9 颗粒中,从而防止它们造成进一步伤害。这种保护机制有效地限制了损伤,确保它不会在细胞内无节制地扩散,造成进一步的混乱。
子细胞中的保障机制
Zhou说,“更令我们着迷的是,我们观察到带有 DHX9 颗粒的细胞总是成对出现,这表明它们并不是在原来受紫外线损伤的母细胞中形成的,而是后来在新生的子细胞中形成的。活细胞视频成像证实了这一假设。你可以清楚地看到,DHX9 通常位于细胞核中,但在细胞分裂后不久,当两个子细胞形成时,它会在细胞质中聚集成液滴。”
有趣的是,阻止子细胞中DHX9颗粒的形成会导致严重的细胞死亡,这凸显了子细胞发现并将母细胞的受损RNA藏匿到DHX9颗粒中的能力。Akhtar说,“这个过程就像把石板擦干净,让它们准备好开始自己的细胞之旅,而不会拖着上一代的包袱。”
了解子细胞如何抵御紫外线引起的亲代RNA损伤,不仅能加深我们对细胞周期的理解,还能为医学研究提供新的可能性。晒伤、神经退行性疾病和癌症等疾病都与 RNA 平衡紊乱和细胞周期不规则密切相关。
Akhtar解释说,“更好地了解新生成的子细胞如何选择性地识别和降解受损的RNA,可能为以RNA控制不善或应激反应失调为特征的疾病找到新的治疗靶点。”
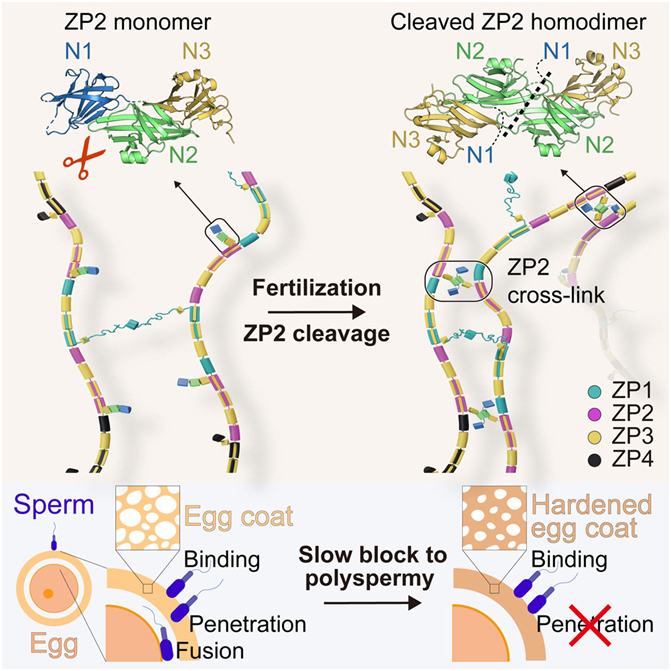
研究人员结合 X 射线晶体学和低温电镜研究了卵外被蛋白的三维结构。他们在小鼠体内对精子与携带 ZP2 蛋白突变的卵子之间的相互作用进行了功能性研究

在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员发现了数千种以前未知的胆汁酸,即一类被肠道微生物组用来与身体其他部分沟通的分子。相关研究结果于2024年3月11日在线发表在Cell期刊上,论文标题为“The underappreciated diversity of bile acid modifications”。

正如论文共同作者、胆汁酸专家Lee Hagey博士所描述的那样,这些研究结果类似于分子罗塞塔石碑(molecular Rosetta Stone),让人们对微生物用来影响远处器官系统的生化语言有了以前未知的了解。
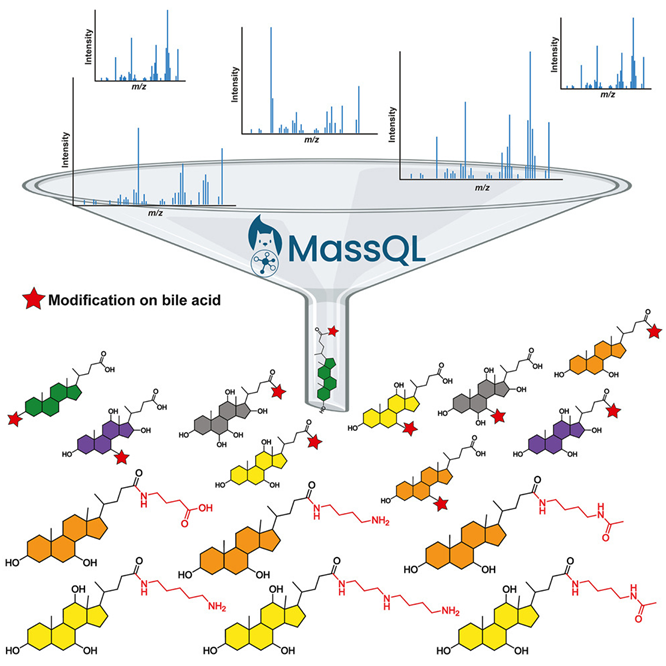
论文共同第一作者、Dorrestein 实验室博士后研究员Helena Mannochio-Russo博士说,“胆汁酸与我们的肠道微生物组相互作用,它们的影响远远超出了消化系统的范围,我们用胆汁酸治疗的疾病也是如此,与胆汁酸有关的疾病清单长达一英里,美国食品药品管理局(FDA)已经批准了几种胆汁酸作为治疗药物。”

这些作者报告了甘氨酸在闭锁状态下与 GlyT1 结合在一起时的结构,同时确定了与甘氨酸共同转运的一个氯离子和两个钠离子的结合位点,从而阐明了转运过程中底物和离子结合的耦合机制。
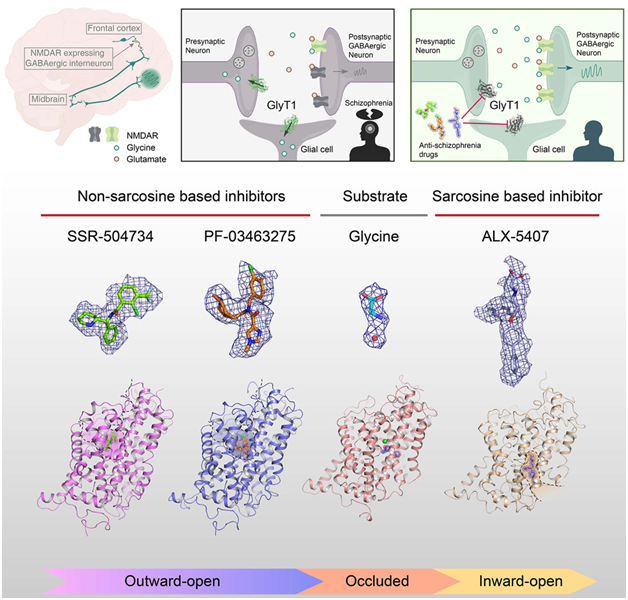
这项新的研究探讨了 GlyT1 的底物识别、离子结合、构象转变以及与临床试验药物的结构-活性关系。这些作者相信,这将有助于加快靶向GlyT1的药物开发进程,为抗精神分裂症药物的设计和开发提供有力的理论支持。
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




