揭示肿瘤释放的细胞外囊泡和颗粒引发肝脏代谢功能异常机制
在一项新的研究中,来自美国威尔康奈尔医学院的研究人员发现癌症经常向血液中释放分子,对肝脏产生病理改变,使得它进入炎症状态,导致脂肪堆积,损害肝脏正常的排毒功能。这一发现揭示了癌症更隐蔽的生存机制之一,并提出了检测和逆转这一过程的新测试和药物的可能性。相关研究结果于2023年5月24日在线发表Nature期刊上,论文标题为“Tumour extracellular vesicles and particles induce liver metabolic dysfunction”。
具体而言,这些作者发现,在肝脏外生长的多种类型的肿瘤通过分泌含有脂肪酸的细胞外囊泡和颗粒(extracellular vesicles and particle, EVP),可以远程将肝脏重编程为类似于脂肪肝的状态。他们在癌症的动物模型和人类癌症患者的肝脏中发现了这个过程的证据。论文共同通讯作者、威尔康奈尔医学院小儿心脏病学教授David Lyden博士说,“我们的发现表明,肿瘤可以导致包括肝脏疾病在内的重大系统性并发症,而且还表明这些并发症可以通过未来的治疗来解决。”在过去的二十年里,Lyden和他的研究团队一直在研究癌症的全身影响。这些影响反映了癌症用来确保其生存和加速其进展的特定策略。例如,在他们于2015年发表的一项研究中,Lyden团队发现胰腺癌分泌的分子被包裹在细胞外囊泡中,这些囊泡通过血液流动,被肝脏摄取,并使该器官准备好支持新的、转移性肿瘤的生长。在这项新的研究中,这些作者发现了一系列由远处的癌细胞引起的不同的肝脏变化,他们在骨癌、皮肤癌和乳腺癌的动物模型中观察到这些癌细胞转移到其他器官,但没有转移到肝脏。他们的关键发现是,这些肿瘤诱导脂肪分子在肝细胞中积累,从而以一种类似于肥胖和酒精相关疾病(即脂肪肝)的方式重编程肝脏。这些作者还观察到经过重编程的肝脏有高水平的炎症,其标志是肿瘤坏死因子-α (TNF-α)水平升高,以及称为细胞色素P450的药物代谢酶水平低,细胞色素P450可以分解潜在的有毒分子,包括许多药物分子。观察到的细胞色素P450水平的降低可能解释了为什么癌症患者随着病情的进展往往对化疗和其他药物的耐受性降低。他们将这种肝脏重编程追溯到远处肿瘤释放的EVP,这些EVP携带脂肪酸,特别是棕榈酸(palmitic acid)。当被称为库普弗细胞(Kupffer cell)的肝脏驻留免疫细胞摄取时,携带的脂肪酸引发了TNF-α的产生,从而推动脂肪肝的形成。
尽管这些作者在研究中主要使用了癌症的动物模型,但他们在新诊断的胰腺癌患者的肝脏中观察到类似的变化,这些患者后来出现了非肝脏转移。论文共同第一作者、Lyden实验室博士后Gang Wang说,“我们更引人注目的观察之一是,这种由EVP诱导的脂肪肝并没有与肝转移同时发生,这表明引发脂肪肝和为肝转移做准备是癌症用来操纵肝功能的不同策略。”这些作者猜测,脂肪肝在一定程度上是通过将肝脏变成基于脂质的能量来源来推动癌症的生长而使癌症受益。论文共同第一作者、威尔康奈尔医学院胃肠病学与肝病学部门的Robert Schwartz博士说,“我们在肝细胞中不仅看到了脂肪的异常积累,而且还看到了脂质的正常处理方式的转变,因此,正在产生的脂质对癌症更有利。”这可能不是癌症从这种肝脏改变中获得的唯一好处。论文共同第一作者、威尔康奈尔医学院儿科细胞与发育生物学助理教授Haiying Zhang说,“还有一些参与免疫细胞功能的关键分子,但它们的生产在这些脂肪肝中被改变,这提示着这种情形也可能削弱了抗肿瘤免疫力。”这些作者能够通过实施诸如阻断肿瘤EVP释放、抑制棕榈酸包装到肿瘤EVP中、抑制TNF-α活性或消除实验动物模型中的库普弗细胞等策略来减轻肿瘤对肝脏的这些系统性影响。他们正在进一步探究在人类患者身上实施这些策略的可能性,这有可能阻止肿瘤对肝脏的这些远程影响,并探索利用检测血液中循环的肿瘤EVP中的棕榈酸作为晚期癌症的潜在警告信号的可能性。
来自爱丁堡大学等机构的科学家们通过研究表示,深入研究阿尔兹海默病患者大脑中积累的损伤性蛋白的扩散机制或有望帮助开发阻断这种疾病进展的新型疗法。在阿尔兹海默病中,纤维状tau病变会在大脑中发挥积累并扩散,从而导致突触丧失;通过对小鼠模型进行研究,研究者发现,tau蛋白能通过突触传递的方式从突触前扩散到突触后,而且低聚物tau蛋白具有一定的突触毒性,但关于人类大脑中突触tau的相关数据很少。近日,一篇发表在国际杂志Neuron上题为“Synaptic oligomeric tau in Alzheimer's disease—a potential culprit in the spread of tau pathology through the brain”的研究报告中,来自爱丁堡大学等机构的科学家们通过研究表示,深入研究阿尔兹海默病患者大脑中积累的损伤性蛋白的扩散机制或有望帮助开发阻断这种疾病进展的新型疗法。文章中,研究者发现,能通过大脑发送基本信号的突触或许也能在大脑周围运输名为tau蛋白的毒性蛋白。称之为缠结(tangles)的tau蛋白团块会在脑细胞中形成,且是阿尔兹海默病的决定性特征之一,当这些团块在疾病期间在大脑中扩散时,患者机体大脑的功能就会下降。研究人员对大脑的突触进行了研究,突触是能促使化学和电信号在脑细胞之间流动的关键连接,且对于健康大脑的功能非常重要,而阿尔兹海默病则能攻击突触,且缺失强烈预示着机体记忆和思维能力的下降。
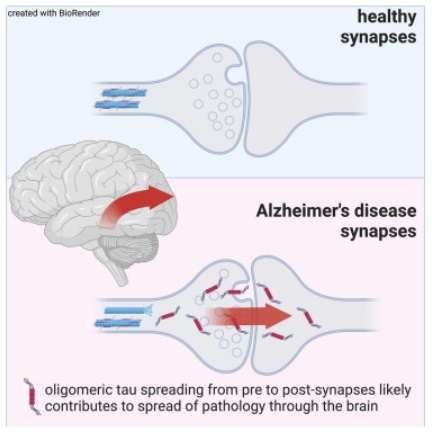
图为 揭示毒性tau蛋白在机体大脑中扩散的分子机制这项研究中,研究人员利用强大的显微镜技术来分析100多万个突触,并对42名个体机体的单一突触中的蛋白质进行可视化研究,结果发现,名为tau低聚体的蛋白质tau小团块或许存在于已故阿尔兹海默病患者的突触中。研究人员在突触两端能观察到tau低聚体的缠结,即从发送信号的脑细胞和接受信号的脑细胞中,在阿尔兹海默病的小鼠模型中,低聚体能从突触的一侧跳跃到另一侧,并通过大脑来扩散毒性tau蛋白。研究者表示,在突触位点降低低聚体tau蛋白或许有望作为一种非常有希望的策略来阻断疾病的进展;阿尔兹海默病是一种最常见的痴呆症,目前仅在英国就影响着90万人的健康,研究人员预计这一数字在2040年会上升到近160万,该病会引起严重的记忆丧失,目前尚无有效的治愈手段。综上,本文研究结果表明,特异性地降低突触处的低聚体tau蛋白或许有望作为未来治疗人类阿尔兹海默病的潜在治疗性策略。
来自纪念斯隆凯特琳癌症中心等机构的科学家们通过研究将复杂的遗传工程化小鼠模型与先进的计算方法相结合,成功地绘制出了导致胰腺导管腺癌发生的最早期的细胞状态。对癌症的讨论经常会强调通过改变细胞蛋白质的正常功能来驱动疾病的遗传突变,比如KRAS,其在正常情况下会扮演细胞增殖的开关,但该基因的突变(常见于肺癌、结直肠癌和胰腺癌等)通常会导致开关处于开启状态。然而,突变或许仅仅只是故事的一半,这些遗传突变和外部因素(比如导致炎症的组织损伤)之间的相互作用会以一种促进癌症出现和失控生长的方式来重塑细胞的身份和局部环境。在胰腺癌中,这些改变开始会快速发生,即在组织损伤后的24至48小时内,其发生是可预测的,而且其会明显扩张某些细胞与附近细胞交流和相互作用的能力。近日,一篇发表在国际杂志Science上题为“Epigenetic plasticity cooperates with cell-cell interactions to direct pancreatic tumorigenesis”的研究报告中,来自纪念斯隆凯特琳癌症中心等机构的科学家们通过研究将复杂的遗传工程化小鼠模型与先进的计算方法相结合,成功地绘制出了导致胰腺导管腺癌(PDAC,pancreatic ductal adenocarcinoma)发生的最早期的细胞状态,胰腺导管腺癌是一种最常见的胰腺癌类型。尽管近年来胰腺癌患者的5年生存率一直在逐步上升,但根据胰腺癌行动网络(Pancreatic Cancer Action Network)数据显示,目前胰腺癌患者的生存率也仅为12%,该疾病通常直到患者癌症晚期才会被发现,而且部分病例的发现还得益于科学家们在治疗其它类型癌症上的进展,因此,目前胰腺癌仍然是全球人群第三大癌症相关死亡的主要原因。这项研究旨在阐明诱发胰腺癌的难以研究的早期细胞事件,而且还有望帮助科学家们找到在疾病早期进行医学干预的潜在机会。细胞摆脱其原始身份并适应环境的能力称之为可塑性(plasticity),而且这种可塑性会被炎症所增强,研究者表示,这些癌变前细胞能获得发送和接收远多于正常细胞的信号的能力,而且这或许并不是随机发生的,而是具有一定结构性的,当在不同的小鼠机体中进行相关实验时,研究人员就能观察到相同的模式一次又一次地出现。为了研究表达突变版本的KRAS细胞的可塑性的起源和影响,研究人员利用一种遗传工程化的小鼠模型进行研究,对其正常、炎症、癌变前和恶性肿瘤组织进行单细胞分析,旨在准确重现人类胰腺癌发生的方方面面,包括从其最开始发生到最后癌症转移等。这些模型或许就能促使研究人员捕捉到胰腺上皮细胞从健康状态向恶性状态进展时所发生的最早变化,这种单细胞分析也能促使研究人员有效区分每个进展阶段胰腺癌内部单一细胞亚群的特征,以及其之间的相互作用是如何驱动胰腺癌进展的。这个项目需要大量的计算创新,而这均是由Cassandra来主导的,研究人员必须开发出一系列方法来回答那些通常并不会被问及的关于可塑性、细胞间交流沟通和肿瘤进展的相关问题。
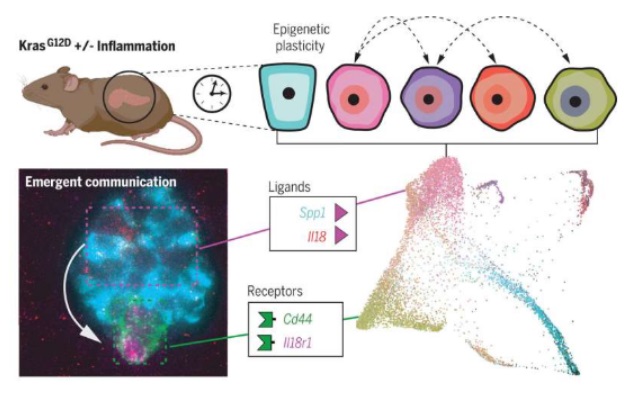
图为 细胞间交流的扩张或会驱动胰腺癌的早期发生和发展比如,研究人员发明了一种新型分类分数体系来衡量细胞的可塑性,他们发现,增加可塑性或会增强与细胞交流沟通相关基因的表达,比如那些编码配体和受体的基因;基本上,这些就是能促使细胞发送和接收来自环境以及其它细胞的信号的特殊基因,这或许也能促使细胞对正常细胞无法产生反应的信号产生反应,同时其与免疫细胞之间交流沟通的能力也得到了加强,因此,这些细胞周围的免疫系统就会开始发生改变。此外,研究人员还能确定,其中一些相当罕见的亚群细胞或许会转变为主要的通信枢纽,并驱动特殊的反馈回路,从而促进胰腺癌的发生和进展。Alonso-Curbelo博士表示,这项研究是实验科学和计算科学之间真正的合作,计算模型通过后续实验也得到了验证,比如,成像研究表明,计算方法所提及的相互交流的细胞群体或许就会在组织中彼此之间明显靠近;通过进一步的实验,研究人员就能阐明这种相互交谈或许会驱动癌症的进展。此外,研究人员还开发了新型小鼠模型来特异性地阻断与肿瘤可塑性相关的细胞间信号转导,这些分析结果表明,这些扩张的通讯网络会在小鼠机体中指导胰腺肿瘤的形成。作为一个整体,研究人员还深入揭示了携带KRAS基因突变拷贝的细胞如何获得可塑性并在受到炎症影响时驱动癌症的进展。最后研究者表示,本文研究提供了一条路线图,其或能帮助开发新型策略,在胰腺癌进展到无法治愈的阶段前来检测甚至预防胰腺肿瘤的形成;同时,理解细胞间交流沟通网络驱动胰腺癌发生的机制也有望帮助开发新型策略,从而早期阻断或减缓癌症甚至更晚期疾病的进展。
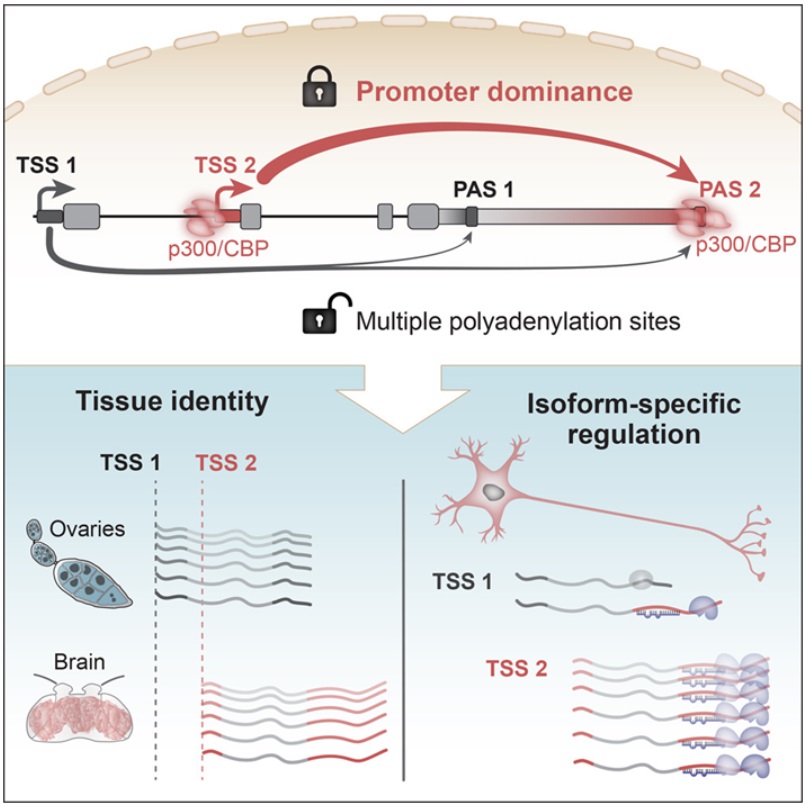
揭示对大多数基因而言,转录开始位点决定了转录结束位点
我们DNA中的每个基因都有开始和结束。正确确定基因的开始和结束对于产生功能性蛋白至关重要。人们已做了大量的研究来确定是什么决定了一个基因何时、何地以及在DNA的哪个位点“开始”。但是基因在哪里结束则是另一回事---转录终止位点的选择一直被认为取决于下游元件和外在因素。一种有机体内的所有细胞都包含相同的DNA序列。决定单个细胞和组织的特性和功能的是在特定时间、特定地点具有活性的一组基因。这些有活性的基因从DNA模板转录成不同的信使RNA(mRNA)分子,并将编码细胞发挥功能所需的蛋白。在基因组中称为启动子(promoter)的特定地方,一种复杂的分子机器开始将DNA序列转录成mRNA。有趣的是,大多数基因包含多个可能的转录开始或结束的位点。这意味着对于每个基因来说,根据起始或终止位点的不同,mRNA可以是不同的。以不同的变体表达一个基因,可以将基因组的多样性和功能扩大许多倍。与此同时,这为基因组的研究增加了另一层的复杂性。在这项新的研究中,这些作者想知道每个基因使用了多少个不同的起点和终点,以何种方式组合,以及这些组合在不同条件下是否不同。论文通讯作者、马克斯-普朗克免疫生物学与表观遗传学研究所的Valérie Hilgers说,“回答这个问题所面临的技术问题是,我们必须从每个基因的起点到终点读取所有基因产生的每个mRNA分子。这是一项前所未有的艰巨任务。”这些作者使用了一种经过调整的下一代测序技术来读出各个mRNA。对于传统的短读测序,每个mRNA被分解成较短的片段,这些片段被扩增,然后被测序以产生读取片段。随后利用生物信息学技术将这些读取片段像拼图一样拼成一个连续的序列。为了获得包括大脑在内的多种果蝇组织的全长mRNA信息,这些作者优化了特定的长读测序技术。论文第一作者、马克斯-普朗克免疫生物学与表观遗传学研究所的Carlos Alfonso-Gonzalez说,“长读测序允许检索比广泛使用的标准测序长得多的测序片段(sequencing reads)。然而,我们甚至不得不优化这项技术,将典型的读取片段长度增加几倍,以便在我们不同的模型系统中获得全长的mRNA信息。”除了果蝇之外,Hilgers实验室还将人类的神经系统模型纳入了他们的研究:脑类器官--在培养皿中用诱导性多能干细胞(iPS)培养的“迷你大脑(mini-brain)”。在转录开始时就预先确定了转录结束位点。这些收集到的在全分子尺度上代表每个mRNA的数据使人们对单个基因的转录有了前所未有的见解。Hilgers 说,“我们意识到,转录起始位点(TSS)和转录结束位点(TES)不是随机组合在一起的,我们发现TSS往往与不同的TES特异性关联在一起。”这种关联性实际上是有因果关系的:比如在卵巢中,人为地激活通常只在大脑中使用的TSS,它会覆盖正常的TES并人为地诱导了大脑TES的使用。这显示了TSS在塑造每个组织特有的RNA景观方面的关键作用,从而影响了组织特性。然而,有一个现象很突出。Alfonso-Gonzalez 说,“某些TSS显示出意想不到的支配行为。它们覆盖了结束转录的常规信号,在其他TSS的竞争中胜出,并导致了对不同TES的选择。因此,我们将它们命名为优势启动子(dominant promoter)。”此外,这些作者发现,这些优势启动子与其相关的基因结束位点之间的相互作用是由不同的表观遗传学特征引导的。重要的是,这些在果蝇脑细胞中获得的研究结果在人脑类器官中得到再现,表明启动子优势是一种保守的,也许是普遍的机制,用于调节功能蛋白的产生和脑细胞的功能。这种新机制的生理学意义可能是什么?通过深入的序列保守性分析,这些作者发现TSS和TES表现出共同进化:在不同物种间数百万年的进化过程中,优势启动子的基因起始位点的单个核苷酸变化伴随着相应基因结束位点的变化。Hilgers说,“我们将这一观察解释为通过进化的推动,维持基因起始和结束位点之间的相互作用,这意味着这些连接性对动物的适应性具有重要意义。”母乳中的酸γ-亚麻酸在新生儿出生后协助心脏正常运作
在一项在小鼠身上开展的新研究中,来自西班牙国家心血管研究中心的研究人员发现母乳提供了一个重要的信号,触发了出生后心脏代谢的成熟,使新生儿的心脏能够正常运作,并确保出生后的生存。相关研究结果于2023年5月24日在线发表在Nature期刊上,论文标题为“γ-Linolenic acid in maternal milk drives cardiac metabolic maturation”。这项新的研究指出母乳中的脂肪酸γ-亚麻酸(gamma-linolenic acid, GLA)与心脏细胞中的类视黄醇X受体(retinoid X receptor, RXR)蛋白结合。RXR作为脂类和维生素A衍生物的营养传感器,改变基因表达并影响生物功能,如免疫、细胞分化和代谢。一旦被母体GLA激活,RXR就会启动遗传程序,为线粒体(细胞的能量中心)配备它们所需的酶和其他蛋白,以便开始消耗脂质,其中脂质是成熟心脏的主要能量来源。这些发现可能对涉及线粒体和代谢功能障碍的心血管疾病,以及与产后发育过程改变有关的疾病具有重要的治疗意义。在一种小鼠模型中,这些作者发现,心脏中缺乏RXR或母体乳汁中缺乏GLA,会阻止新生小鼠心脏中的线粒体正确产生能量,导致严重的心力衰竭和出生后24至48小时的死亡。新生哺乳动物的心脏必须迅速产生能量以维持子宫外的心脏收缩。为了实现这一目标,心肌细胞,即心肌收缩细胞,需要激活其线粒体,使用脂质作为产生ATP(三磷酸腺苷,即细胞的基本能量货币)的能量来源。尽管这一过程对有机体的生存至关重要,但是在此之前,人们对触发出生后心脏生理适应的信号所知甚少。论文通讯作者、西班牙国家心血管研究中心的Mercedes Ricote博士解释说,“由于需要保持持续和不间断的跳动,这对心脏提出了巨大的能量需求。为了满足其能量需求,心肌细胞对产生能量的细胞途径保持着严格的控制。这些生物能量机制的任何不平衡都会导致严重的心血管病症的发生。”对于Ricote博士来说,这项研究的部分新颖性“在于证实了RXR在心肌中发挥着关键作用,这与之前的想法不同。这是核受体领域的一个重要概念性进展”。据论文第一作者Ana Paredes博士的说法,这项研究为理解新生哺乳动物为满足子宫外环境的要求而出现的产后适应提供了一个新的框架。Paredes博士解释说,“出生对新生儿来说是一个生理上的挑战。通过这项研究,我们发现母乳除了具有营养功能外,还发挥着信号传导的作用,指示心肌细胞需要激活它们的代谢,因为它们不再受到母体生理学的支持。”总之,这项新的研究表明,母乳中的脂肪酸GLA是确保出生后心脏功能正确的关键信号。GLA激活了细胞蛋白RXR,然后指导协调的基因表达变化,以确保心肌细胞线粒体的成熟,以便它们能够在子宫外环境中产生能量。这些研究结果为用特定药物调节心肌细胞中的RXR活性的治疗方法开辟了道路,包括一些已经获得美国食品药物管理局(FDA)批准用于癌症治疗的药物。Ricote博士总结说,“我们的研究提出了RXR作为新生儿由心脏疾病和代谢错误引发的系统性疾病的可能治疗靶标。”文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。
返回列表