重大进展!揭示一种新的不依赖于细菌感染的伤口修复机制
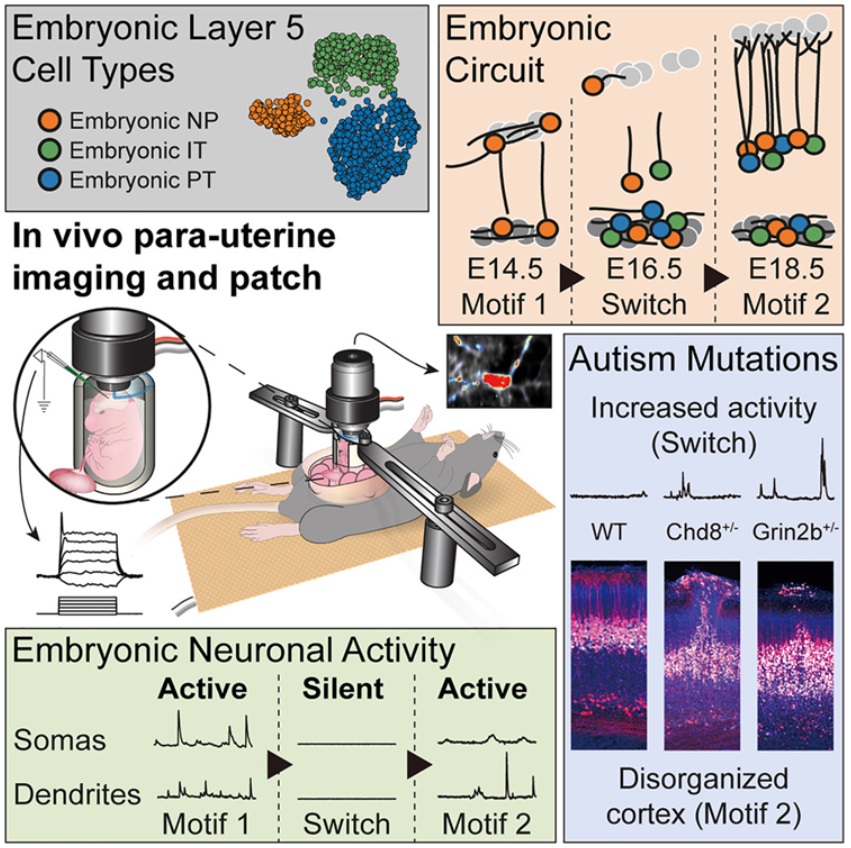
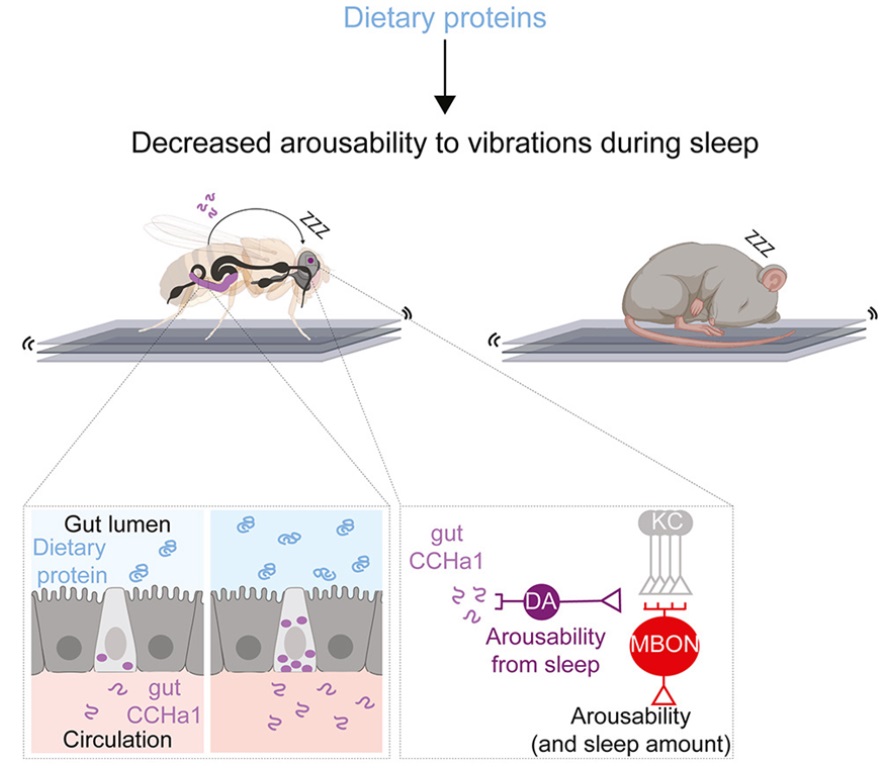
外面的世界很危险。从细菌和病毒到事故和伤害,威胁每时每刻围绕着我们。没有什么比我们的皮肤更坚定地保护我们。作为身体内部和外部的屏障以及身体最大的器官,皮肤也是它最完美的防御。然而,皮肤并不是无敌的。它每天都在承受着巨大的冲击,它试图通过感知和应对这些伤害来保护我们的安全。一种主要的方法是检测病原体,这将使免疫系统开始行动。但是,在一项新的研究中,美国洛克菲勒大学的Elaine Fuchs博士及其研究团队揭示了一种对受伤组织中的损伤信号---包括由于血管破裂和结痂导致的低氧水平---作出反应的替代性保护机制,而且它不需要感染就能进入状态。相关研究结果于2023年4月24日在线发表在Cell期刊上,论文标题为“A tissue injury sensing and repair pathway distinct from host pathogen defense”。这项新的研究首次确定了一种与病原体引发的经典途径不同但平行的损伤反应途径。在这种损伤反应中起主导作用的是一种称为白细胞介素-24(IL-24)的蛋白,编码IL-24的基因在伤口边缘的皮肤上皮干细胞中经诱导后活化。一旦释放出来,这种分泌的蛋白开始招募一系列不同的细胞,从而开始复杂的伤口愈合过程。Fuchs说,“IL-24主要由伤口边缘的表皮干细胞制造,但皮肤的许多细胞---上皮细胞、成纤维细胞和内皮细胞---都表达IL-24受体并对这种信号作出反应。IL-24成为协调组织修复的协调者。”科学家们早已了解宿主反应如何保护我们的身体免受病原体感染引起的威胁:体细胞将入侵的细菌或病毒识别为外来实体,并在信号传导蛋白(比如1型干扰素)的帮助下激活一些防御机制。但身体如何对可能涉及或不涉及外来入侵者的损伤作出反应?例如,如果我们在切黄瓜时切到了手指,我们马上就知道了---出血和疼痛。然而,对损伤的检测如何导致愈合在分子基础上知之甚少。虽然1型干扰素依靠信号传导因子STAT1和STAT2来调节对病原体的防御,但Fuchs实验室以前的研究已表明,一种类似的称为STAT3的转录因子在伤口修复中出现。论文共同第一作者Siqi Liu想要追踪STAT3途径,以了解它的起源。IL-24作为一种主要的上游细胞因子脱颖而出,在伤口中诱导STAT3激活。这些作者在无菌条件下对小鼠进行研究,发现伤口诱导的IL-24信号级联反应不依赖于细菌。但是,是什么损伤信号诱导了这一信号级联反应呢?伤口往往延伸到皮肤真皮层,那里有毛细血管和血管。论文共同第一作者Yun Ha Hur说,“我们了解到,表皮干细胞能感知伤口的缺氧环境。”当血管被切断并结痂时,伤口边缘的表皮干细胞会缺氧。这种缺氧状态是细胞健康的警钟,并诱发了涉及转录因子HIF1a和STAT3的正反馈回路,放大了伤口边缘的IL-24产生。结果就是表达IL-24受体的多种细胞类型协调努力,通过替换受损的上皮细胞、愈合断裂的毛细血管和为新的皮肤细胞产生成纤维细胞来修复伤口。与纪念斯隆-凯特琳癌症中心的Craig Thompson团队合作,这些作者指出他们可以通过改变氧气水平来调节IL-24基因表达。一旦他们确定了表皮干细胞中组织修复途径的起源,他们研究了经基因改造后缺乏IL-24功能的小鼠的伤口修复过程。如果没有这种关键蛋白,伤口愈合过程是缓慢和延迟的,比正常小鼠需要更多天才能完全恢复皮肤。他们推测,IL-24可能参与了以起到保护作用的上皮层为特征的其他身体器官的损伤反应。在近期的研究中,重症COVID-19患者的肺上皮组织和溃疡性结肠炎(一种慢性炎症性肠病)患者的结肠组织中都发现了IL-24活性的升高。Hur说,“IL-24可能作为一种线索来提示许多器官中发出需要进行损伤修复的信号。”Fuchs解释说,“我们的发现提供了对一种重要的不依赖于细菌感染的组织损伤检测和修复信号传导途径的新见解。”德克萨斯大学西南医学中心进化生物学家Qian Cong进行的分析显示,IL-24及其受体与干扰素家族有着密切的序列和结构同源性。尽管它们可能并不总是每时每刻都在协调工作,但IL-24和干扰素在进化上是相关的,并与细胞表面上相互靠近的受体结合在一起。这些作者猜测这些信号传导分子来自于一种相同的分子途径,可以追溯到我们的过去。Liu说,“我们认为,在数亿年前,这个祖先可能已经分裂成两条途径---一条是病原体防御,另一条是组织损伤。”也许这种分裂的发生是为了应对大量的给地球上的生命带来了巨大麻烦的病原体和损伤。在一项新的研究中,来自瑞士巴塞尔分子与临床眼科学研究所和巴塞尔大学的研究人员利用一种新的方法在单细胞分辨率下研究活的胚胎小鼠大脑,发现了一个活跃的多层回路,该回路在发育的早期阶段在大脑皮层中形成。从遗传上扰乱该回路导致了与自闭症患者大脑中所看到的类似的变化。相关研究结果于2023年4月17日在线发表在Cell期刊上,论文标题为“Pyramidal neurons form active, transient, multilayered circuits perturbed by autism-associated mutations at the inception of neocortex”。论文通讯作者、巴塞尔分子与临床眼科学研究所主任Botond Roska说,“了解大脑皮层中细胞类型和回路的详细发育可以为自闭症和其他神经发育疾病提供重要的见解。这就是我们的发现所证实的。”长期以来,自闭症一直与大脑皮层的错误回路有关,而大脑皮层是管理感官知觉、认知和其他高阶功能的部分。大脑皮层的大部分是由称为锥体神经元(pyramidal neuron)的兴奋性细胞组成。这些作者希望研究这些神经元何时以及如何在大脑皮层中组装成第一批活跃的回路,但这构成了一个困难的挑战。锥体神经元的宽度只有人类头发的十分之一,在实验过程中的任何移动都可能导致活动记录的不准确。为了在研究中保持这些神经元的稳定,Roska及其研究团队设计了一种手术解决方案:胚胎被固定在母体腹腔内充满琼脂的三维保持装置内,这样就可以维持正常的胚胎血流和温度。目前普遍流行的观点是,大脑皮层以“由内向外”的方式发育,它的六层中最深的一层首先出现。以这种方式来看,人们认为锥体神经元在迁移到大脑皮层的最终位置并形成彼此之间的联系时,会慢慢变得活跃。但是,论文共同第一作者、巴塞尔分子与临床眼科学研究所中央视觉回路小组系统神经科学家Arjun Bharioke说,在这项研究过程中,“我们实际上检测到了一种非常不同的活动模式。”Roska团队特别关注发育为大脑皮层第5层的锥体神经元,发现了一个非常早期的瞬态回路,该回路甚至在这种6层的大脑皮层形成之前就已经高度活跃和相互关联了。这表明这些神经元在迁移形成第5层之前就已经连接在一起了。这个瞬态回路最初有2层:一个深层(deep layer)和一个浅层(superficial layer)。后来,浅层变得沉默并消失了,而这种经典的逐层皮层发育恢复了,第三中间层形成了第5层。论文共同第一作者、巴塞尔分子与临床眼科学研究所中央视觉回路小组发育生物学家Martin Munz说,“我们还想了解这一回路在自闭症模型中是如何变化的。”这些作者利用缺少两个自闭症相关基因---Chd8和Grin2b---的一个或两个等位基因的基因敲除小鼠品系,取得了一项关键发现。众所周知,这些基因的缺失会导致儿童出现严重的自闭症。在纯合和杂合的基因敲除小鼠中,这个浅层作为一种发育的残余物仍然活跃。Munz说,“在整个胚胎发育过程中,它从未消失。”此外,基因敲除小鼠的大脑包含了类似于在自闭症患者身上看到的皮层混乱的斑块区域。Bharioke说,这些发现表明,锥体神经元的空间分布受到这个新发现的回路的调节,而且“胚胎回路的变化在与神经发育障碍有关的功能障碍中起作用,包括自闭症谱系障碍”。Roska说,在未来的研究中,Roska团队将“仔细观察这个早期回路的深层和浅层,并独立操纵它们”。“这对了解神经发育疾病的病因将具有指导意义。”睡眠是人类最基本的活动之一---事实上,如果我们哪怕只有一个晚上没有得到足够的睡眠,我们就可能难以思考、反应以及以其他方式度过一天。然而,尽管它对功能和生存非常重要,科学家们仍然没有完全理解睡眠是如何运作的。在一项新的研究中,美国哈佛医学院布拉瓦特尼克研究所神经生物学副教授Dragana Rogulja及其同事们利用果蝇和小鼠来探索人类为什么需要睡眠,以及在睡眠期间如何与世界断开联系。相关研究结果发表在2023年3月30日的Cell期刊上,论文标题为“A gut-secreted peptide suppresses arousability from sleep”。长期以来,科学家们一直遵循这样的原则,即睡眠属于大脑,由大脑控制,并为大脑服务。因此,之前的研究在很大程度上集中在大脑方面,寻找睡眠对于生存来说是必要的原因。然而,如今,这些作者意识到虽然睡眠可能是为了大脑,但它不仅仅是为了大脑。睡眠是一种超级古老的行为,他们认为它起源于最早期的动物。这些动物没有大脑;它们只有一种非常简单的神经系统。然后,随着动物变得更加复杂,这些与大脑有关的睡眠目的也随之演变。然而,科学家们观察了被剥夺睡眠的动物的大脑,试图找到它们死亡的原因,结果并没有取得发现。另一方面,临床数据显示,人类的睡眠剥夺会导致身体的多种疾病。从某方面来说,这确实表明睡眠不仅仅是关于大脑的。在这项新的研究中,这些作者指出当涉及到睡眠时,人们需要停止将大脑与身体分开思考。为了解决神经科学中这个最大的谜团,他们需要采取一种更综合的方法,这就是Rogulja实验室在睡眠方面的努力。他们发现人类真地需要思考整个身体来理解睡眠。当入睡时,人体的肌肉会放松,人体的血液循环会改变。当然,这是关于整个身体的。从历史上看,很多睡眠研究都是在人类身上进行的,但这些实验往往是有限的和描述性的,因为无法真正在人类身上进行实验。然而,在过去的25年里,科学家们已认识到果蝇也会睡觉;最近,Rogulja团队又发现调节果蝇睡眠的基因在小鼠身上是保守的。当他们开始他们的实验时,他们只使用果蝇作为研究睡眠的模型系统,但后来也能够建立一种小鼠模型。果蝇使他们能够快速地测试很多假设,并进行大型的、无偏见的遗传筛选,然后他们可以在小鼠身上测试在果蝇身上取得的发现,因为小鼠作为哺乳动物,与人类更为相似。在之前的一项新的研究中,Rogulja团队已发现睡眠少的果蝇寿命更短:他们看到一种相关性,即果蝇失去的睡眠越多,它们的死亡速度越快(Cell, 2020, doi:10.1016/j.cell.2020.04.049)。有趣的是,睡眠剥夺的模式并不重要。重要的是睡眠不足的程度。似乎存在一个表明睡眠不足与死亡有关的转折点,这说明与一般的磨损相比,身体可能会发生一些特定的事情。为了进一步研究这个问题,Rogulja团队用细胞损伤的标记物对睡眠不足的果蝇的不同器官进行染色。他们发现,在肠道中,氧化分子有所增加,而氧化的峰值与果蝇开始死亡的这个转折点相关。他们在被剥夺睡眠的小鼠身上证实了这一发现。但当他们给被剥夺睡眠的果蝇服用抗氧化剂或激活肠道中产生抗氧化剂的基因时,他们发现这些果蝇可以在很少或没有睡眠的情况下存活下来,这表明肠道是睡眠的一种非常重要的靶标。这些研究结果表明,如果人们能够防止肠道内的氧化,也许能够抵消失去睡眠的影响。这很重要,因为很多疾病都与肠道功能紊乱有关,当睡眠不足时出现的很多疾病实际上可能是肠道损伤的后果。这些作者如今开始思考如何诊断人类缺乏睡眠导致的肠道氧化。他们想要设计“可吞咽物”---人们可以吞下的药丸或药片,通过改变排出的粪便颜色来报告肠道的氧化状态。这些作者还在寻找生物标志物:已经在体内循环的、表明缺乏睡眠和肠道氧化的分子。Rogulja实验室里有医生正在对被剥夺睡眠的小鼠进行分析,以寻找这类生物标志物。他们已经有一些分子是有希望的氧化标志物,并且似乎随着抗氧化剂治疗而减少。最终,也许有可能设计出可以口服的补充剂,以扭转因缺乏睡眠而导致的肠道氧化现象。在这项新的研究中,Rogulja团队探讨了大脑在睡眠期间如何与环境断开联系。在此之前,目前还不清楚大脑中是否有一个地方在睡眠时所有的感觉信息都被减弱,或者是否有多个这样的地方。例如,在睡眠期间,触摸和温度的处理方式是否相同?Rogulja实验室的博士后研究员Iris Titos建立了一种系统,可以向果蝇提供温和、中等或高水平的振动。通常情况下,当使用低强度的振动时,很少有果蝇醒来,而当使用高强度的振动时,几乎所有的果蝇都有反应。然后,他们做了一项大规模的遗传筛选,以确定控制果蝇如何容易醒来的基因---使果蝇超级容易醒来的基因,以及让果蝇在地震中基本上睡着的基因。这项遗传筛选的结果非常有趣。Rogulja团队确定了一个编码称为CCHa1的分子的基因。当他们剔除果蝇体内的CCHa1时,它们非常容易醒来---因此,在特定的振动水平下,不是20%的果蝇醒来,而是90%的果蝇醒来。然而,虽然CCHa1在神经系统和肠道中都存在,但只有当他们在肠道中剔除它时,果蝇才更容易被唤醒。肠道中产生CCHa1的细胞被称为肠道内分泌细胞(enteroendocrine cell),它们实际上与神经元具有许多特征,甚至可以与神经元连接和交流。这些细胞面向肠道内部,它们有点像“品尝”肠道的内含物。Rogulja团队发现,饮食中蛋白的浓度越高,这些肠道内分泌细胞产生的CCHa1就越多。然后这种分子从肠道到达大脑,在那里它向一小群多巴胺能神经元发出信号,这些神经元也接收有关振动的信息。这些神经元产生通常会促进唤醒但在这种情况下会抑制唤醒的多巴胺。振动削弱了多巴胺能神经元的活动,这导致果蝇更容易醒来。肠道产生的CCHa1基本上缓冲了多巴胺能神经元对振动的影响,使果蝇能够在更大程度上忽略环境,睡得更深。Rogulja团队还发现,CCHa1途径虽然对机械感觉信息的门控至关重要,但对果蝇在暴露于热的情况下是否容易醒来没有影响,这表明不同的感觉模式(比如振动和温度)可以独立门控。最后,他们发现,蛋白含量高的饮食也改善了小鼠的睡眠质量,使它们对机械干扰的抵抗力更强。他们如今正在测试小鼠体内是否有类似的信号传导途径。从其他研究中人们已知道,当动物挨饿时,它们会抑制睡眠,以便进行觅食。相比之下,当它们吃饱时,特别是当它们通过摄入蛋白吃饱时,它们往往会睡得更多。如今,Rogulja团队发现当饮食中有更多的蛋白时,动物也会睡得更深,反应更少。这表明,如果动物不需要寻找食物,它们可以与环境断开联系,躲在某个地方睡觉,这可能更安全。更广泛地说,我们的研究提示着饮食选择影响睡眠质量。如今,科学家们可以在人类身上探索这种联系,以了解如何操纵饮食来改善睡眠。Rogulja认为人们应该意识到的一件事是,我们的感觉和我们身体里发生的事情不一定相同。在这项新的研究中,他们发现有可能将困倦的感觉与睡眠的需要分开---一些睡眠不足的动物不一定感到困倦,可以看出这是因为它们在停止睡眠剥夺后没有额外的睡眠来补足睡眠,但这些动物仍然因为缺乏睡眠而死亡。这意味着,即使人们可以欺骗自己不觉得困,睡眠不足仍然会对身体产生负面影响---例如,如果服用了一种让人们感到清醒的物质,肠道也会发生同样数量的氧化。人们可能会说他们每晚只睡几个小时没关系,但他们的意思是他们可以熬过一天。他们的身体仍然会记录睡眠不足的情况。科学家们真地不知道由于睡眠不足,人们的身体发生了什么变化,人们可能需要比自己认为的更多的睡眠。揭示饮食和益生菌增强黑色素瘤免疫疗法反应的分子机制
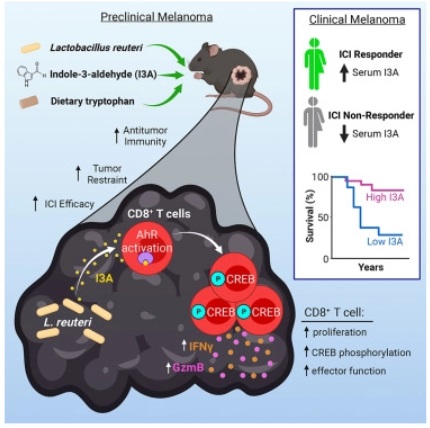
来自匹兹堡大学等机构的科学家们通过对患有黑色素瘤的小鼠进行研究后发现,益生菌能从肠道中游走并在肿瘤中建立起来从而直接刺激免疫细胞,让癌症免疫疗法变得更加有效起来。如今,癌症患者对益生菌的使用正在不断增加,包括那些接受免疫检查点抑制剂(ICI)疗法的患者等。近日,一篇发表在国际杂志Cell上题为“Dietary tryptophan metabolite released by intratumoral Lactobacillus reuteri facilitates immune checkpoint inhibitor treatment”的研究报告中,来自匹兹堡大学等机构的科学家们通过对患有黑色素瘤的小鼠进行研究后发现,益生菌能从肠道中游走并在肿瘤中建立起来从而直接刺激免疫细胞,让癌症免疫疗法变得更加有效起来。研究者表示,罗伊氏乳杆菌(Lactobacillus reuteri)能通过分泌名为吲哚-3-醛(I3A,indole-3-aldehyde)的化合物来刺激杀伤性T细胞发挥功能;当研究人员给予小鼠富含氨基酸色氨酸(细菌能将色氨酸转化为I3A)的饮食时,免疫疗法药物在抑制肿瘤尺寸和延长小鼠生存率上表现出更强的效果,相关研究结果或为研究人员进行临床试验来检测是否I3A疗法或将益生菌和饮食结合来改善接受免疫疗法的黑色素瘤患者的治疗结局奠定了一定的基础。图为 揭示饮食和益生菌增强黑色素瘤免疫疗法反应的分子机制研究者Marlies Meisel说道,我们都知道,肠道微生物会影响免疫疗法的反应,但对于其是如何做到这一点的,以及是否其能从肠道中发挥作用或者其是否必须在肿瘤部位发挥作用,还有很多问题需要去解答。本文研究首次揭示了,口服细菌或许就能促使细菌移动到肠道外部的肿瘤中,并直接影响肿瘤中的免疫细胞从而增加癌症免疫疗法的疗效。肠道微生物组是免疫疗法(能帮助宿主机体免疫系统识别并杀灭癌细胞)为何对一些患者有效而对其它患者无效的一个重要因素,最近多项研究发现了黑色素瘤患者机体中益生菌补充剂和免疫疗法反应之间的关联。为了了解更多,研究人员就给予黑色素瘤无菌小鼠喂食罗伊氏乳杆菌,该菌通常是市售益生菌的一部分,研究者发现,罗伊氏乳杆菌能从肠道转移到肿瘤中,并在其中建立生存地并长期存在。相比没有接受细菌的对照组小鼠而言,给予罗伊氏乳杆菌的小鼠的肿瘤部位有着更多且更加有效的CD8+ T细胞,且肿瘤会萎缩很多,小鼠的寿命也会更长。而且罗伊氏乳杆菌的影响效应并不仅限于黑色素瘤中,在腺癌、纤维瘤和乳腺癌的小鼠模型中,其都能同样移动到肠道外的肿瘤中并抑制癌症生长。通过深入研究后,研究人员发现,罗伊氏乳杆菌能通过产生I3A来刺激肿瘤的免疫力,而I3A能激活CD8细胞中的受体;尽管该受体在机体几乎所有的细胞中都存在,但I3A能专门作用于CD8细胞从而增强机体杀灭癌症的能力;当研究人员移除这些细胞中的受体时,细菌就不会再诱导机体的抗肿瘤免疫力了,这就表明,这种效应或许依赖于CD8+ T细胞的这种受体,I3A对于细菌增强机体的抗肿瘤免疫力和肿瘤抑制的效果非常重要。尽管包括黑色素瘤在内的肠道以外的肿瘤微生物组如今已经被描述过了,但肿瘤微生物在介导癌症免疫疗法中所扮演的积极性角色的概念尚未被阐述过;因此,研究人员非常惊讶地发现,肿瘤中的罗伊氏乳杆菌所产生的I3A能增强免疫疗法反应,而肠道内罗伊氏乳杆菌的存在却并不足以具有一定的抗肿瘤效应。为了观察是否I3A在人类对免疫疗法的反应上所扮演的关键角色,研究者Meisel等人进行了联合研究;此前他们发现,通过粪便移植来修饰肠道菌群或能改善黑色素瘤患者的免疫反应。当分析了接受免疫检查点抑制剂疗法的黑色素瘤患者机体的血液样本后,研究者发现,对免疫疗法反应较好的患者机体中I3A的水平较高,在治疗前机体中高水平的I3A或许与患者更好的生存机会有关。将来在这些研究发现的基础上,研究人员或许能利用I3A的水平来作为生物标志物预测哪些患者更会对免疫疗法产生反应;研究者非常感兴趣的另一个方向就是开发临床试验来评估是否将I3A与免疫疗法结合就能改善患者的治疗结局。罗伊氏乳杆菌需要色氨酸(一种存在于诸如鸡肉、大豆等食物中的氨基酸)来旨在I3A,当黑色素瘤小鼠摄入富含色氨酸的食物时,其机体的肿瘤就会生长缓慢,而且小鼠的寿命也要比摄入较低水平色氨酸的相同饮食的对照小鼠更长,因此,高色氨酸的饮食会增强免疫疗法促使肿瘤萎缩的影响效应。研究者提醒道,后期或许还需要进行更多的研究(包括控制良好的临床试验)来理解是否富含色氨酸的饮食能影响癌症患者的治疗结果。本文研究或许并不应该作为一项建议,而是作为一种开端,研究者希望其或许能促使其它研究调查饮食如何影响机体的免疫力和癌症治疗结局。目前他们的实验室非常感兴趣理解诸如饮食或生活方式改变等整体策略,从而增强免疫疗法和其它癌症疗法的疗效。综上,本文研究结果揭示了I3A在促进晚期黑色素瘤患者接受免疫检查点抑制疗法疗效和生存率上所扮演的关键角色。在一项新的研究中,奥地利科学技术研究所的Gaia Novarino教授及其团队发现,一组氨基酸在大脑发育的某些阶段发挥着关键作用。让神经元缺乏这些氨基酸导致了出生后的严重影响。大脑发育由一连串协调的步骤组成,这些步骤主要由我们的基因指导。在这些步骤中,大脑中的神经元的正确定位和功能是至关重要的---神经元的无功能或不正确的定位会导致严重的神经病理后果。协调这一程序的基因突变往往与神经发育障碍有关;然而,环境应激,如营养匮乏或营养不良也会影响大脑的发育。然而,人们对特定营养物的重要性以及大脑发育过程中代谢的作用仍然知之甚少。在一项新的研究中,奥地利科学技术研究所的Gaia Novarino教授及其团队如今揭开了这个大脑之谜。在与维也纳几所大学的合作中,他们分析了小鼠大脑中的这个营养程序。他们发现,一组氨基酸---包括色氨酸、酪氨酸、异亮氨酸、亮氨酸、缬氨酸、蛋氨酸、苯丙氨酸、苏氨酸---在大脑发育的某些阶段发挥着关键作用。让神经元缺乏这些氨基酸导致了出生后的严重影响。小鼠患上了小头畸形(microcephaly)---大脑大小的减少,这种情况一直持续到成年,最终导致长期的行为变化,类似于在自闭症谱系障碍(ASD)中观察到的情况。相关研究结果于2023年3月29日在线发表在Cell期刊上,论文标题为“Large neutral amino acid levels tune perinatal neuronal excitability and survival”。代谢物是我们分解食物时产生或使用的物质,从而为我们的身体提供燃料。在这些代谢物中,一组代谢物---大型中性氨基酸(large neutral amino acid, LNAA)---引起了科学家们的注意。LNAA是人体不能自行合成的必需氨基酸,必须通过食物摄取。论文第一作者、奥地利科学技术研究所博士生Lisa Knaus解释说,“通过检查整个大脑发育过程中的代谢物水平,它们似乎对出生后的神经发育期尤为重要。”此前,Novarino团队发现了一种新型的自闭症,在这种自闭症中,由于一个称为SLC7A5的基因存在遗传缺陷,患者无法将LNAA转移到大脑中。这种可能的联系触发了Knaus的调查天性。“我们对氨基酸在大脑发育中的作用产生了真正的兴趣。”这些作者接着进行了条件性敲除实验---一种在某些小鼠细胞中剔除特定基因的方法,产生了突变小鼠品系。将这些品系与健康小鼠进行比较使得他们能够评估基因剔除是否导致特征性状的改变。在这项新的研究中,Novarino团队剔除了Slc7a5基因,该基因携带的指令用于表达将LNAA带入神经元的转运蛋白。换句话说:神经元缺乏必要的氨基酸。在胚胎阶段,大脑的形成似乎是好的。然而,刚出生后,神经元就开始受到低水平LNAA的影响。在这一时期,突变小鼠由于大脑皮层的厚度减少,与健康小鼠相比出现了小头畸形。为了了解更多,这些作者采用了一种方法来标记和操纵单个神经元。他们发现,大脑皮层上层的一大部分神经元在出生后的头几天里消失了。这些细胞正在死亡,但为什么会如此呢?事实证明,缺乏LNAA的神经元活性较低。Knaus解释说,“不正常放电的神经元在出生后不久就被淘汰了。这就像自然选择一样,只有最合适的细胞才能存活。”行为的长期变化
在这个关键时期过后,神经元的死亡和活动率恢复正常。然而,较小的大脑尺寸一直持续到成年。突变体小鼠开始表现出几种行为异常,包括运动障碍、社交能力缺陷和多动症。虽然不是完全的再现,但这些行为模式与SLC7A5基因突变的患者非常相似,他们也表现出小头症、自闭症和运动障碍。
Knaus总结说,“我们的研究详细地展示了即使是代谢和营养物供应的微小变化也会对大脑发育和功能产生严重后果。”
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。
返回列表












 京公网安备 11011402010692号
京公网安备 11011402010692号




