在一项新的研究中,来自美国斯坦福大学的研究人员设计了一种荧光激活细胞分选方法,从人类大脑组织中分离出不同的神经干细胞和祖细胞类型。这项研究中使用的标志物在不同的大脑区域都是保守的。该技术应有助于未来的神经发育研究,并加速开发基于神经细胞移植的治疗方案,以治疗一系列神经系统疾病。相关研究结果发表在2023年3月16日的Cell期刊上,论文标题为“Purification and characterization of human neural stem and progenitor cells”。

人脑拥有约1710亿个细胞,其中略高于一半(约860亿)是神经细胞。这860亿个神经细胞是一个多样化的细胞群体,有数百种专门的类型和功能,但都源自三个神经细胞谱系---神经元、少突胶质细胞和星形胶质细胞。这三个细胞谱系都是从神经干/祖先放射状胶质细胞(neural stem and progenitor radial glia cell)池开始的,这些神经干/祖先放射状胶质细胞在产前妊娠的第二个三个月经历了快速发育。了解这些放射状胶质细胞,它们如何分化成这三个细胞谱系,以及这三个谱系如何分化成多样化的神经细胞,将对医学研究有巨大的好处。
荧光激活细胞分选用于从单细胞悬浮液中根据细胞表面免疫表型分离脑组织中的细胞类型。细胞经过索引(荧光记录)并相互分离。这些分离的细胞接受单细胞RNA测序,以捕获它们各自的转录组。通过将表面标志物谱与索引和转录组相结合,这些作者如今有了每个细胞类型的图谱,可用于以后的识别。他们还测量了最初分离方案中没有使用的另外352种表面标志物的表达,这些标志物可能在未来更好地区分细胞。
索引排序数据允许每种被测序的细胞对应到它们的原始免疫表型,而且这些作者发现RNA和细胞表面蛋白的表达并不总是相关的。一些看起来相似的细胞可能有不同的功能。这种策略产生了功能相似的分选细胞群体,从而允许分离出特定的神经干细胞和祖细胞类型来进行分析。
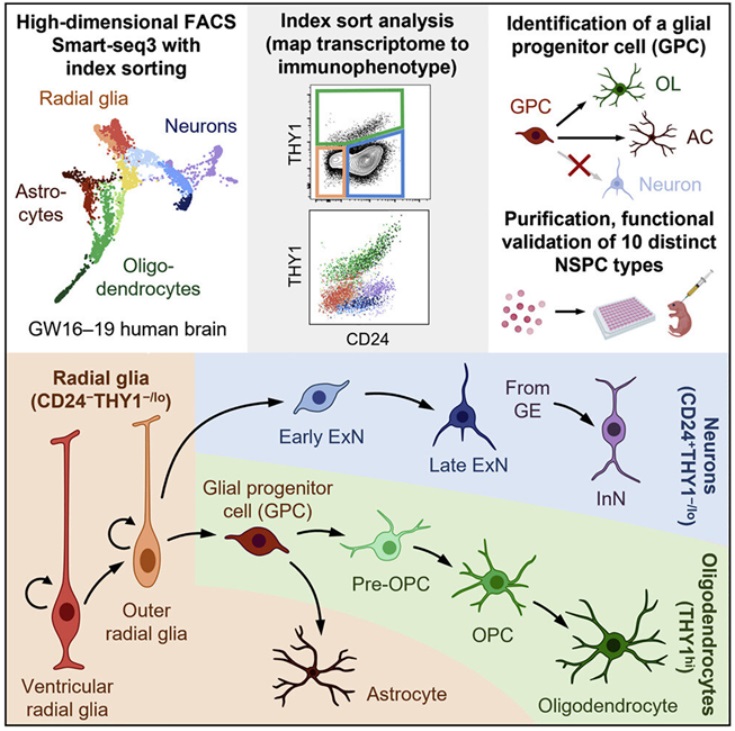
这些作者确定了10种神经干/祖细胞类型,并通过将它们直接移植到新生儿免疫缺陷小鼠的大脑中来确定这些细胞的行为特征。6个月后,这些细胞在整个大脑中广泛迁移和定植,并分化出所有三种主要的神经细胞谱系。通过观察单个细胞类型的扩散方式和位置,他们可以对适宜的活动位点做出一些初步推断。虽然该实验仅仅是作为一种方法的可行性测试,但是他们确实确定了一种以前没有描述过的独特的双能性胶质祖细胞(bipotent glial progenitor cell)的功能特征。这些作者成功地进行了概念验证,并发现可以根据细胞表面标志物从发育中的大脑中分离出不同的细胞类型。如果所使用的方法可以推广到其他干细胞类型,科学家们对细胞在大脑或其他器官中发挥的特定功能、机制和层次作用的理解可能会激增。
在一项新的研究中,来自美国加州大学洛杉矶分校等研究机构的研究人员发现先进的基因组编辑技术可能能够用于罕见的致命遗传病--- CD3δ重症联合免疫缺陷(D3 delta severe combined immunodeficiency,CD3δSCID)---的一次性治疗。相关研究结果于2023年3月20日在线发表在Cell期刊上,论文标题为“Human T cell generation is restored in CD3δ severe combined immunodeficiency through adenine base editing”。CD3δSCID是由CD3D基因突变引起的,它阻止了CD3δ蛋白的产生,而这种蛋白是造血干细胞正常产生T细胞所需的。没有T细胞,出生时患有CD3δSCID的婴儿无法抵御感染,如果不加以治疗,往往在出生后的头两年内死亡。目前,骨髓移植是唯一可用的治疗方法,但是这种方法有很大风险。
在这项新的研究中,这些作者发现一种名为碱基编辑(base editing)的新型基因组编辑技术可以校正造血干细胞中导致CD3δSCID的突变,并恢复它们产生T细胞的能力。这种潜在疗法是加州大学洛杉矶分校的Donald Kohn博士和Gay Crooks博士的实验室合作的结果。
Kohn实验室之前已成功开发了针对几种免疫系统缺陷的基因疗法,包括其他形式的重症联合免疫缺陷(SCID)。他和他的同事们应加拿大阿尔伯塔儿童医院研究所的小儿血液学和免疫学专家Nicola Wright博士的请求,将注意力转向了CD3δSCID,当时Wright正在为她的患者寻找更好的治疗方案。
CD3δSCID在加拿大和墨西哥之间移民的门诺派教徒社区很普遍。Wright说,“由于墨西哥没有对新生儿进行SCID筛查,我经常看到一些婴儿被诊断得很晚,回到加拿大后病得很重。”
当Kohn向他的实验室提出Wright的请求时,当时在加州大学洛杉矶分校大四结束时加入Kohn实验室的研究助理Grace McAuley站出来提出了一个大胆的想法。Kohn说,“McAuley建议我们尝试碱基编辑,这是我的实验室以前从未尝试过的一项非常新的技术。”
碱基编辑是一种超精确的基因组编辑形式,使科学家们能够校正DNA中的单碱基突变。DNA由四种碱基---A、T、C和G---组成;这些碱基配对形成了DNA双螺旋梯形结构中的“横档(rungs)”。其他基因编辑平台,如CRISPR-Cas9,会切割染色体的两条链来改变DNA,而碱基编辑是通过化学方法将一种DNA碱基变成另一种(比如将A变成G),而让染色体保持完整。
McAuley说,“一开始我有一个非常陡峭的学习曲线,当时碱基编辑并不奏效。但我继续向前推进。我的目标是帮助将这种疗法以尽可能快的速度推广到临床。”
McAuley联系了布罗德研究所的David Liu(碱基编辑的发明者),就如何评估该技术在这一特定用途中的安全性寻求建议。最终,McAuley确定了一种能高效校正致病基因突变的碱基编辑器。

由于这种疾病极为罕见,为这项新的研究获取患者的造血干细胞是一项重大挑战。当Wright向这项研究提供了一名正在接受骨髓移植的CD3δSCID患者捐赠的造血干细胞后,该项目得到了推动。这种碱基编辑器在三项实验室实验中,平均校正了该患者近71%的造血干细胞。接下来,McAuley与加州大学洛杉矶分校风湿病学临床讲师Gloria Yiu博士合作,测试校正后的造血干细胞是否能产生T细胞。Yiu使用人工胸腺类器官,这是Crooks实验室开发的模拟人类胸腺环境的干细胞衍生组织模型。当这些经过校正的造血干细胞被引入人工胸腺类器官时,它们产生了功能齐全的成熟T细胞。Yiu说,“由于人工胸腺类器官能有效地支持成熟T细胞的发育,它是一个理想的系统,表明对患者造血干细胞进行碱基编辑能修复这种疾病中的缺陷。”作为最后一步,McAuley通过将经过校正的造血干细胞移植到小鼠体内,研究了它们的寿命。移植后四个月,这些经过校正的造血干细胞仍然存在,表明碱基编辑已校正了真正的、自我更新的造血干细胞中的突变。这些研究结果表明,校正后的造血干细胞可以长期存在,并产生患者健康生活所需的T细胞。这些作者正在研究如何将这种新方法带入加拿大、墨西哥和美国的CD3δSCID婴儿的临床试验中。这项研究中描述的治疗方法仅用于临床前测试,尚未在人类身上进行测试,也未被美国食品药品管理局(FDA)批准可安全和有效地用于人类。该技术被提交专利申请,Kohn和McAuley被列为共同发明人。
揭示特定组蛋白突变导致严重神经发育综合征的遗传机制
在一项新的开创性研究中,来自加拿大麦吉尔大学等研究机构的研究人员通过研究三种特定组蛋白突变(H3.3G34R、H3.3G34V和H3.3G34W)的发育后果,揭示了导致严重神经发育综合征的遗传机制。就像修剪树木有助于促进适当的生长一样,大脑利用突触修剪(synaptic pruning)来去除其细胞之间不必要的连接。然而,当这一发生在幼儿期和成年期的正常过程不能正常停止时,大脑会失去太多的连接,包括一些重要的连接。由于这种过度的突触修剪,一些脑细胞死亡,另一些脑细胞引起炎症,从而导致运动、思考和学习方面的问题。 在一项新的开创性研究中,来自加拿大麦吉尔大学等研究机构的研究人员弄清了这一错误过程是如何发生的。他们通过研究三种特定组蛋白突变(H3.3G34R、H3.3G34V和H3.3G34W)的发育后果,揭示了导致严重神经发育综合征的遗传机制。具体而言,他们发现了在由这些生殖系突变--存在于生殖细胞中并被整合到每个细胞的DNA中的突变---引起的疾病中,大脑是如何受损的。相关研究结果发表在2023年3月16日的Cell期刊上,论文标题为“Single substitution in H3.3G34 alters DNMT3A recruitment to cause progressive neurodegeneration”。他们的研究结果不仅可能有助于科学家们找到治疗这些疾病的新方法,而且也为研究其他涉及脑细胞损失和炎症的神经系统疾病(比如阿尔茨海默病)以及据猜测存在过度突触修剪的疾病(如精神分裂症)提供了启示。论文通讯作者、麦吉尔大学健康中心研究所的Nada Jabado博士说,“神经元不能被替换。找到可能影响它们的机制很重要,并为急需的治疗性干预措施打开了大门,这既是为了在神经元损失变得重要之前抑制炎症;也是为了长期遏制疾病。”论文共同作者、麦吉尔大学人类遗传学副教授Claudia Kleinman博士补充说,“神经变性是我们随着年龄增长所面临的主要问题之一。任何新的见解都是受欢迎的,因为需求是巨大的,我们的发现可能会对这一破坏性的问题提出另一种解释。”持续性而非暂时性的修剪这项新的研究显示,组蛋白基因的特定突变导致染色质(由DNA和组蛋白形成,经压缩后可变成染色体)特定区域上的“信标(beacons)”表达减少。这些信标通常会招募DNMT3A,即一种能够根据招募区域沉默或激活基因的酶。它们的减少使得基因能够继续产生有助于突触修剪过程的蛋白。因此,本应停止的突触修剪继续进行,造成大脑损伤。论文共同作者、麦吉尔大学外科系助理教授Livia Garzia博士解释说,“我们知道,严重的神经发育综合征与较小的大脑;行走、吃饭和说话存在困难以及学习困难有关,是由组蛋白的某些生殖系突变引起的。在这项新的研究中,我们证实了当组蛋白不能正常工作并让大脑制造出比需要的更多的炎性蛋白而导致渐进性神经退化时会发生什么。”这一切都从两名患者开始Jabado博士团队确定了一名H3.3G34R新生生殖系突变(不是从父母那里遗传的)的患者。该患者与另一名携带H3.3G34V突变的患者表现出共同的特征。这两名患者从出生起就有严重的神经发育迟缓,在出生后的发育过程中更加恶化。在2岁时,他们也有严重的生长延迟和小头症。
在一项新的开创性研究中,来自加拿大麦吉尔大学等研究机构的研究人员弄清了这一错误过程是如何发生的。他们通过研究三种特定组蛋白突变(H3.3G34R、H3.3G34V和H3.3G34W)的发育后果,揭示了导致严重神经发育综合征的遗传机制。具体而言,他们发现了在由这些生殖系突变--存在于生殖细胞中并被整合到每个细胞的DNA中的突变---引起的疾病中,大脑是如何受损的。相关研究结果发表在2023年3月16日的Cell期刊上,论文标题为“Single substitution in H3.3G34 alters DNMT3A recruitment to cause progressive neurodegeneration”。他们的研究结果不仅可能有助于科学家们找到治疗这些疾病的新方法,而且也为研究其他涉及脑细胞损失和炎症的神经系统疾病(比如阿尔茨海默病)以及据猜测存在过度突触修剪的疾病(如精神分裂症)提供了启示。论文通讯作者、麦吉尔大学健康中心研究所的Nada Jabado博士说,“神经元不能被替换。找到可能影响它们的机制很重要,并为急需的治疗性干预措施打开了大门,这既是为了在神经元损失变得重要之前抑制炎症;也是为了长期遏制疾病。”论文共同作者、麦吉尔大学人类遗传学副教授Claudia Kleinman博士补充说,“神经变性是我们随着年龄增长所面临的主要问题之一。任何新的见解都是受欢迎的,因为需求是巨大的,我们的发现可能会对这一破坏性的问题提出另一种解释。”持续性而非暂时性的修剪这项新的研究显示,组蛋白基因的特定突变导致染色质(由DNA和组蛋白形成,经压缩后可变成染色体)特定区域上的“信标(beacons)”表达减少。这些信标通常会招募DNMT3A,即一种能够根据招募区域沉默或激活基因的酶。它们的减少使得基因能够继续产生有助于突触修剪过程的蛋白。因此,本应停止的突触修剪继续进行,造成大脑损伤。论文共同作者、麦吉尔大学外科系助理教授Livia Garzia博士解释说,“我们知道,严重的神经发育综合征与较小的大脑;行走、吃饭和说话存在困难以及学习困难有关,是由组蛋白的某些生殖系突变引起的。在这项新的研究中,我们证实了当组蛋白不能正常工作并让大脑制造出比需要的更多的炎性蛋白而导致渐进性神经退化时会发生什么。”这一切都从两名患者开始Jabado博士团队确定了一名H3.3G34R新生生殖系突变(不是从父母那里遗传的)的患者。该患者与另一名携带H3.3G34V突变的患者表现出共同的特征。这两名患者从出生起就有严重的神经发育迟缓,在出生后的发育过程中更加恶化。在2岁时,他们也有严重的生长延迟和小头症。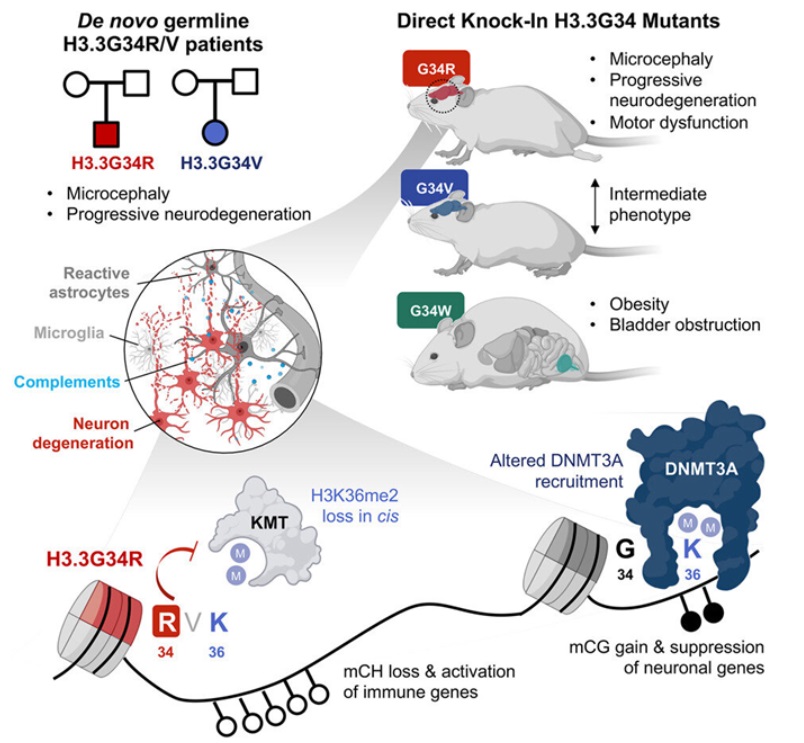 Jabado博士解释说,“这两名患者都有其他临床症状,如喂养困难、重复手部动作和耐药性 癫痫,他们都不能走路或说话,这表明H3.3G34R/V生殖系突变严重损害了他们的大脑发育和神经认知功能。然而,H3.3G34R突变患者表现出一种独特的发育退步,表现为坐立能力的丧失,以及社会交往能力的下降。”对每种突变的独特观察为了了解H3.3G34生殖系突变的发育后果,这些作者利用胚胎编辑技术设计了携带H3.3G34R、H3.3G34V和H3.3G34W突变的小鼠。他们报告说,小鼠的神经系统损伤在青春期和成年早期表现出来,并随着年龄的增长逐渐恶化。他们还指出H3.3G34R、H3.3G34V和H3.3G34W突变以令人惊讶的不同方式从根本上影响大脑发育。比如,H3.3G34R突变对组织的影响与H3.3G34R G34W突变不同;携带H3.3G34R突变的小鼠表现出严重的神经系统改变,而携带H3.3G34W突变的小鼠有膀胱、输尿管生殖器缺陷和病态肥胖;携带H3.3G34R突变的小鼠,但不是携带H3.3G34W突变的小鼠,显示出运动功能受损;作为一种由于肌肉控制不良而影响协调、平衡和语言的疾病,共济失调(ataxia)严重影响了携带H3.3G34R突变的小鼠并导致其死,而且它确实在一定程度上影响了携带H3.3G34V突变的小鼠,但在携带H3.3G34W突变的小鼠模型中却没有;H3.3G34R突变,以及在较小程度上的H3.3G34V突变而不是H3.3G34W突变,诱发了渐进性小头畸形。Jabado博士说,“在我们的研究中,我们能够检测到H3.3G34R、H3.3G34V和H3.3G34W突变小鼠的显著发育差异,让人联想到在携带H3.3G34突变的患者身上观察到的特异性。我们阐明了H3.3G34R突变在发育中的大脑中介导的表观遗传失调可能导致这种突变所特有的神经系统缺陷。”这些作者因他们在癌症和脑瘤方面的工作而闻名国际,特别是在组蛋白基因的突变方面,正是在这种背景下,他们最初在实验室中研究令人H3.3G34突变。有一次,他们偶然发现小鼠表现出特定H3.3G34突变所具有的神经变性的表型,并发现了有类似症状的神经变性患者。
Jabado博士解释说,“这两名患者都有其他临床症状,如喂养困难、重复手部动作和耐药性 癫痫,他们都不能走路或说话,这表明H3.3G34R/V生殖系突变严重损害了他们的大脑发育和神经认知功能。然而,H3.3G34R突变患者表现出一种独特的发育退步,表现为坐立能力的丧失,以及社会交往能力的下降。”对每种突变的独特观察为了了解H3.3G34生殖系突变的发育后果,这些作者利用胚胎编辑技术设计了携带H3.3G34R、H3.3G34V和H3.3G34W突变的小鼠。他们报告说,小鼠的神经系统损伤在青春期和成年早期表现出来,并随着年龄的增长逐渐恶化。他们还指出H3.3G34R、H3.3G34V和H3.3G34W突变以令人惊讶的不同方式从根本上影响大脑发育。比如,H3.3G34R突变对组织的影响与H3.3G34R G34W突变不同;携带H3.3G34R突变的小鼠表现出严重的神经系统改变,而携带H3.3G34W突变的小鼠有膀胱、输尿管生殖器缺陷和病态肥胖;携带H3.3G34R突变的小鼠,但不是携带H3.3G34W突变的小鼠,显示出运动功能受损;作为一种由于肌肉控制不良而影响协调、平衡和语言的疾病,共济失调(ataxia)严重影响了携带H3.3G34R突变的小鼠并导致其死,而且它确实在一定程度上影响了携带H3.3G34V突变的小鼠,但在携带H3.3G34W突变的小鼠模型中却没有;H3.3G34R突变,以及在较小程度上的H3.3G34V突变而不是H3.3G34W突变,诱发了渐进性小头畸形。Jabado博士说,“在我们的研究中,我们能够检测到H3.3G34R、H3.3G34V和H3.3G34W突变小鼠的显著发育差异,让人联想到在携带H3.3G34突变的患者身上观察到的特异性。我们阐明了H3.3G34R突变在发育中的大脑中介导的表观遗传失调可能导致这种突变所特有的神经系统缺陷。”这些作者因他们在癌症和脑瘤方面的工作而闻名国际,特别是在组蛋白基因的突变方面,正是在这种背景下,他们最初在实验室中研究令人H3.3G34突变。有一次,他们偶然发现小鼠表现出特定H3.3G34突变所具有的神经变性的表型,并发现了有类似症状的神经变性患者。
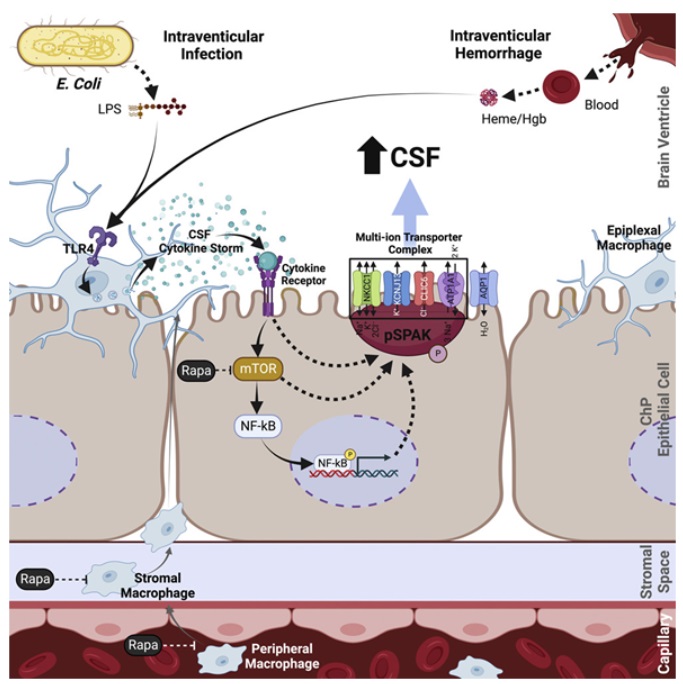
在一项新的研究中,来自美国麻省总医院的研究人员发现了一种导致最常见形式的后天性脑积水(acquired hydrocephalus)的新的分子机制,这有可能为有史以来第一次以非手术方式治疗这种影响到大约一百万美国人的威胁性疾病打开大门。相关研究结果近期发表在Cell期刊上,论文标题为“The choroid plexus links innate immunity to CSF dysregulation in hydrocephalus”。在这项新的研究中,这些作者在动物模型中发现了大脑感染或出血引发大规模神经炎症反应的一种途径,这种神经炎症反应导致称为脉络丛(choroid plexus)的组织产生脑脊液(CSF),从而引起脑室肿胀。论文通讯作者、麻省总医院小儿神经外科医生Kristopher Kahle博士说,“考虑到神经外科充满了巨大的发病率和并发症,找到一种非手术治疗脑积水的方法一直是我们这个领域的最高目标。我们通过全基因组分析方法确定了脑室肿胀的基础机制,这种肿胀发生在后天性脑积水的脑出血或脑感染之后。我们希望这些发现将为治疗脑积水的抗炎药物的批准铺平道路,这可能会改变美国和世界各地无法接受手术的人群的游戏规则。”全球每500名新生儿中就有一人发生后天性脑积水。它是儿童脑部手术的最常见原因,尽管它可以影响任何年龄的人。在世界上的不发达地区,细菌感染导致这种疾病的最常见原因,由于缺乏手术干预,脑积水对儿童来说往往是致命的。事实上,唯一已知的治疗后天性脑积水的方法是脑部手术,包括植入一种类似导管的分流器,以排出脑中的液体。但是根据脑积水协会(Hydrocephalus Association)的说法,小儿患者的所有分流器中约有一半在放置两年内失败,需要重复神经外科手术和终生进行脑部手术。通过破译感染或严重出血后大脑内发生的独特的细胞和分子生物学,这些作者向人类非手术药物治疗迈出了重要一步。这个过程的关键是脉络丛,这个大脑结构经常将脑脊液泵入大脑的四个脑室,以保持该器官在颅内的浮力和无损伤。然而,感染或脑出血会产生危险的神经炎症反应,脉络丛将脑脊液和来自大脑周边的免疫细胞涌入脑室,从而引起即所谓的“细胞因子风暴(cytokine storm)”,使脑室肿胀。论文共同作者、麻省总医院神经外科系主任Bob Carter博士解释说,“过去科学家们认为,感染引起的脑积水和脑出血引起的脑积水涉及完全不同的机制。Kahle博士实验室发现,这两种类型的疾病都涉及相同的途径,而且可以利用诸如雷帕霉素(rapamycin)之类的免疫调节剂靶向这种途径。雷帕霉素是一种已被美国食品药品管理局(FDA)批准用于需要抑制免疫系统以防止器官排斥的移植病人的药物。”这些作者正在继续探索如何将雷帕霉素和其他抑制后天性脑积水中的炎症的药物变成对患者有效的药物治疗。Kahle强调说,“最让我兴奋的是,这种无创疗法可以提供一种方法,帮助那些没有机会接触神经外科医生或分流器的年轻患者。对这些儿童来说,脑积水的诊断不再是致命的。”首次在经过甲基化编辑的哺乳动物中证实了跨代表观遗传的存在
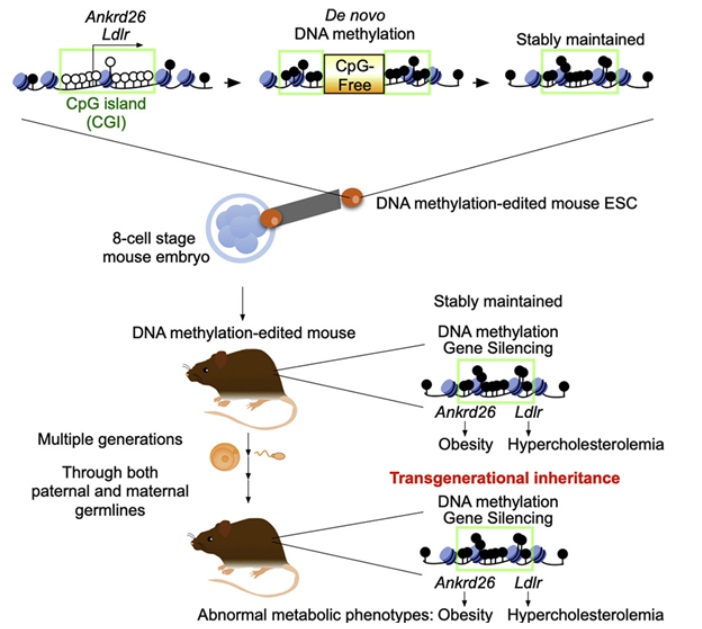
在一项新的研究中,来自美国沙克生物学研究所和西班牙圣安东尼奥天主教大学的研究人员首次在一种经过甲基化编辑的哺乳动物中证实了跨代表观遗传。相关研究结果发表在2023年2月16日的Cell期刊上,论文标题为“Transgenerational inheritance of acquired epigenetic signatures at CpG islands in mice”。在这篇论文中,他们描述了在测试小鼠中设计一种表观遗传突变,并跟踪四代后代的变化。早在20世纪90年代,医学家们就发现,基因表达的变化并不总是由于DNA序列的变化。他们发现,行为和环境因素可以影响基因开启或关闭的方式。最常见的因素是DNA甲基化,即一个甲基分子附着在DNA的一条链上,从而控制相关基因的激活。随后的研究表明基因组甲基化是常见的。近期,医学家们已发现,尽管DNA本身没有变化,但是DNA甲基化可以从父母那里传给孩子---这是怎么实现的仍然是一个谜。在这项新的研究中,这些作者发现这种变化可以在哺乳动物中通过多代传递。这项新的研究涉及将特定的甲基分子添加到测试小鼠胚胎干细胞(ESC)基因组的两个位点上。这阻止了两个与代谢有关的基因--- ANKRD26和LDLR---的激活。然后,他们将这些经过修饰的细胞注射到小鼠胚胎中,然后将接受注射的小鼠胚胎植入一只代孕小鼠的子宫中。随后,这些作者从出生到10个月对所产生的小鼠后代的发育进行跟踪。所有携带经过修饰的细胞的小鼠都出现了肥胖,正如预期的那样。这些作者随后将这些肥胖的小鼠与未携带经过修饰的细胞的小鼠进行了交配,并研究了它们的后代。这些后代再与其他小鼠交配,如此反复四代。所有四代都有携带经过修饰的等位基因,并且都出现了肥胖。该团队进行了几次实验,在一些实验中让经过修饰的雄性小鼠与未经过修饰的雌性小鼠交配,在另一些实验中,让经过修饰的雌性小鼠与未经过修饰的雄性小鼠交配。这没有什么不同;肥胖仍然在小鼠后代中存在。这种性状是如何传递的仍然是一个谜。文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。
返回列表













 京公网安备 11011402010692号
京公网安备 11011402010692号




