在一项新的研究中,研究人员通过结合核酸细胞仪、微流控技术和液滴分选,开发出FIND-seq,可根据数字液滴PCR检测的mRNA生物标志物的表达来分离和分析感兴趣的罕见细胞。
罕见的细胞类型可能对人类健康产生不适当的影响。以前的研究已表明大脑和脊髓中的星形胶质细胞的一个亚群可能是导致多发性硬化症(MS)的原因。在这种疾病中,免疫系统会攻击保护神经的覆盖层。
但要找到这些罕见的细胞并非易事,科学家们需要确定独特的表面标志物,以将这些罪魁祸首细胞与其他细胞区分开来。单细胞RNA测序可以帮助找到它们,即使在没有区分性的表面标志物的情况下,也是如此,但是这种技术可能变得极其昂贵。

为了解决这个问题,在一项新的研究中,来自美国布莱根妇女医院和加州大学旧金山分校等研究机构的研究人员通过结合核酸细胞仪、微流控技术和液滴分选,开发出FIND-seq,可根据数字液滴PCR检测的mRNA生物标志物的表达来分离和分析感兴趣的罕见细胞。相关研究结果于2023年1月3日在线发表在Nature期刊上,论文标题为“Identification of astrocyte regulators by nucleic acid cytometry”。
通过使用这种方法,这些作者非常详细地分析了驱动中枢神经系统炎症和神经退化的星形胶质细胞群体。当与其他工具结合使用时,FIND-seq确定了由盐皮质激素受体NR3C2和NCOR2(nuclear receptor corepressor 2)控制的信号通路,这些信号通路在小鼠和人类的致病性星形胶质细胞的产生中起着重要作用。在另一项研究中,他们利用FIND-seq确定了HIV在接受抗逆转录病毒疗法治疗的患者中用来“躲藏”免疫细胞的机制(Nature, 2023, doi:10.1038/s41586-022-05556-6)。
论文共同通讯作者、布莱根妇女医院神经学系的Francisco Quintana博士说,“这些发现为针对诸如多发性硬化症类的神经系统疾病的治疗干预确定了新的靶标。”这些作者正在努力开发新的可用于在治疗上靶向该信号通路的小分子。
在一项新的研究中,研究人员报告了允许对单细胞进行多维表征(单细胞蛋白基因组分析)的新技术的应用,研究了直接从HIV-1感染者身上分离的HIV病毒库细胞。
感染后不久,HIV-1通过在体内形成病毒库(viral reservoir)---感染了HIV但不积极产生新病毒的细胞,从而建立起终身感染。抗逆转录病毒疗法(ART)降低了血液中的HIV水平,但是一小部分感染这种病毒的细胞会无限期地存在,使HIV感染成为一种不治之症。那些能够在停止ART治疗后重新触发感染的细胞极其罕见,而且直到现在还没有被识别和表征。
在一项新的研究中,来自美国国家过敏与传染病研究所、拉根研究所和麻省总医院的研究人员报告了允许对单细胞进行多维表征(单细胞蛋白基因组分析)的新技术的应用,研究了直接从HIV-1感染者身上分离的HIV病毒库细胞。通过这种新的技术方法,他们发现了标志性的表面标志物,这可能解释了一些HIV病毒库细胞如何能够长期存在并抵抗宿主的免疫反应。这一发现可能为未来治愈HIV感染的策略提供参考。相关研究结果于2023年1月4日在线发表在Nature期刊上,论文标题为“Phenotypic signatures of immune selection in HIV-1 reservoir cells”。

论文通讯作者、哈佛医学院医学教授Mathias Lichterfeld博士说,“高通量单细胞测序如今使我们能够精确地研究极少数受感染细胞的表面特征,尽管接受了ART治疗,这些细胞仍能终身存在,并且在停止治疗后会促进HIV反弹。有了这些知识,我们就能了解它们的易感性和脆弱性,并能开发出靶向这些细胞的定制免疫反应。”
这些作者收集了5名HIV阳性研究参与者的外周血细胞。其中的四名参与者已接受了大约10年的ART治疗,还有1人是尽管没有接受ART治疗但血液中的HIV水平却无法检测出来的“精英控制者(elite controller)”。他们还分析了其中的两名参与者在接受ART治疗仅1-2年后的早期血液样本。他们还收集了三名已接受了10~15年ART治疗的HIV阳性研究参与者的淋巴结细胞。从这些样本中,他们分离出了CD4+记忆T细胞,即在对感染作出反应时产生的白细胞,它们是HIV的主要靶细胞。
这些作者开发了一种新的实验策略,称为表型和前病毒测序(phenotypic and proviral sequencing, PheP-Seq),这是一种单细胞下一代测序技术,用于评估单个病毒感染细胞表面上的生物标志物。利用PheP-Seq,他们分析了53万多个外周血细胞和39.6万个淋巴结细胞。
含有完整HIV前病毒---完整的HIV病毒基因组整入宿主细胞DNA---的HIV病毒库细胞的表面生物标志物经常与对细胞毒性T细胞和NK细胞---两种通常能保护免受病毒感染的免疫细胞---杀伤的抵抗力增加有关。这些HIV病毒库细胞也有限制病毒基因转录的免疫检查点标志物的高表达。这意味着一些HIV-1病毒库细胞具有特定的特性,这些特性可能会减少暴露于免疫系统并被免疫系统杀死,这可能解释为什么它们会持续存在于体内。研究参与者开始ART治疗1~2年后收集的一些HIV-1病毒库细胞已经显示出这些生物标志物和免疫检查点标志物的表达增加,尽管相对于ART治疗后期,这些变化并不明显,而在ART治疗后期,这些抵抗性病毒库细胞变得更容易被识别。来自淋巴结的带有完整病毒的细胞显示出促进细胞存活的表面标志物的上调,使得这些抵抗性病毒库细胞具有选择性优势。
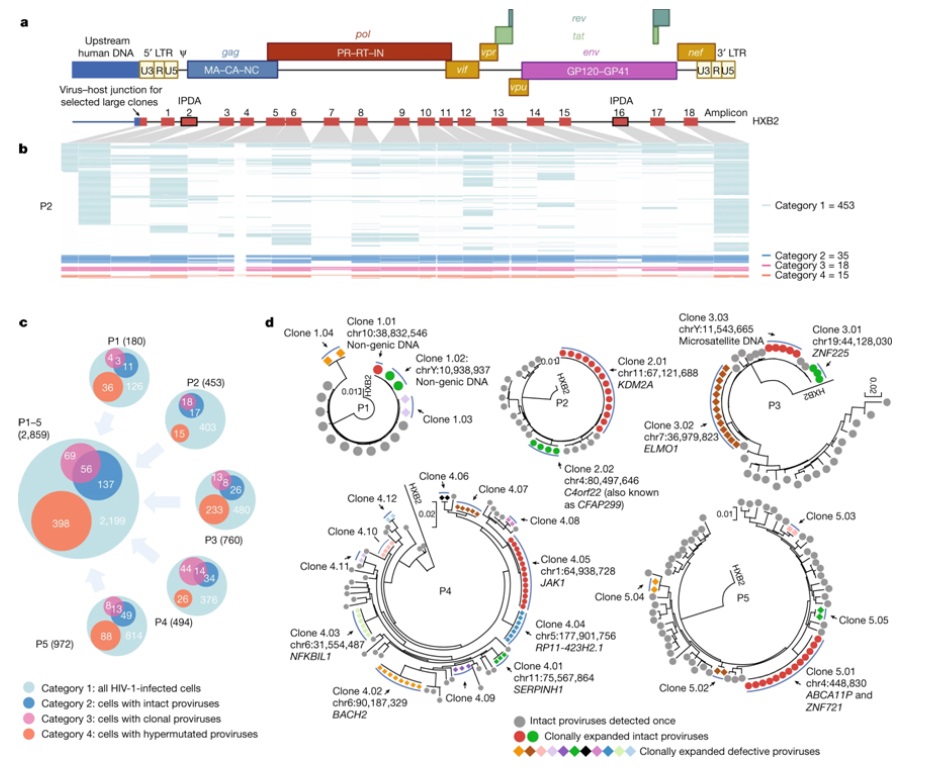
图为 来自外周血的HIV-1感染细胞的细胞表型和前病毒序列的联合评估(PheP-seq)
总体来说,这些结果表明,只有一小部分受感染的病毒库细胞能以最佳方式躲避免疫系统,并在长期ART治疗中存活下来。此外,这些数据表明,人类免疫系统能够对大多数HIV病毒库细胞施加有效的免疫选择压力。
这些作者指出,这些生物标志物不太可能在所有接受ART治疗的HIV感染者中普遍存在,因为免疫选择压力可能因个体免疫反应的差异而不同。尽管如此,识别区分HIV病毒库细胞的表型生物标志物可能为未来的HIV-1治愈研究提供信息。如果科学家们能够开发出旨在加强和加快对HIV-1病毒库细胞的免疫选择的临床策略,他们可能能够减少HIV的长期持续存在并诱发无药缓解。
论文共同作者、拉根研究所所长Bruce Walker博士说,“四十多年来,HIV已缓慢但逐步地揭示了它的秘密,而这是另一个被揭示的关键秘密。将单个病毒库细胞进行可视化观察的能力曾是一个白日梦,而如今已成为现实。如今我们必须在这些信息的基础上根除这些病毒库细胞。”
两篇Nature论文描述了一种新发现的CRISPR-Cas免疫系统的结构和功能,与更知名的让外来基因灭活来保护细胞的CRISPR-Cas系统不同,这种新的系统关闭受感染的细胞来阻挡感染。
像人类一样,细菌和古生菌也会受到病毒的攻击。这些微生物已进化出自己的免疫防御策略,以对抗它们的病原体。细菌防御系统,如CRISPR-Cas系统,具有多样化的蛋白和功能,帮助细菌保护自己免受外来入侵者入侵。
这种免疫防御基于一个共同的机制:CRISPR核糖核酸(CRISPR ribonucleic acid, crRNA)作为“向导RNA(gRNA)”,帮助检测外来基因组(比如病毒DNA)的区域,以便进行靶向切割。由crRNA指导的CRISPR相关(Cas)核酸酶可以像一把剪刀一样切割它的靶标:这是人类在许多技术中利用的一种自然策略。

美国犹他州立大学的生物化学学者Thomson Hallmark和Ryan Jackson与他们的合作者一起,发表了两篇具有开创性的论文。他们的研究结果描述了一种新发现的CRISPR-Cas免疫系统的结构和功能,与更知名的让外来基因灭活来保护细胞的CRISPR-Cas系统不同,这种新的系统关闭受感染的细胞来阻挡感染。相关研究结果于2023年1月4日在线发表在Nature期刊上,论文标题分别为“Cas12a2 elicits abortive infection through RNA-triggered destruction of dsDNA”和“RNA targeting unleashes indiscriminate nuclease activity of CRISPR–Cas12a2”。

作为第一篇论文第一作者的Oleg Dmytrenko博士说,“我们正在探索最初与Cas12a归类在一起的CRISPR核酸酶,这类核酸酶通过识别和切割侵入性DNA来保护细菌。一旦我们发现了更多的它们,我们就意识到它们与Cas12a有足够的不同,可以进行更深入的研究。这种探索使我们发现这些我们称之为Cas12a2的核酸酶,它们不仅与Cas12a有很大的不同,而且与任何其他已知的CRISPR核酸酶也有很大的不同。”
关键的区别在于它们的防御行动机制。当Cas12a2识别入侵的RNA时,该核酸酶会对它进行切割,但也能破坏细胞内的其他RNA和DNA,破坏该细胞的生长并限制感染的扩散。Dmytrenko说,“一般来说,这种称为顿挫性感染的防御策略在细菌中已经被发现。其他一些CRISPR-Cas系统以这种方式工作。然而,一种基于CRISPR的防御机制,依靠单一的核酸酶来识别入侵者并降解细胞DNA和RNA,以前还没有被观察到。”
Cas12a2的蛋白序列和结构将这种核酸酶与Cas12a区分开来。在一种前间隔序列侧翼位点(protospacer-flanking sequence, PFS)的激活下,Cas12a2能识别与它的gRNA互补的靶RNA。靶向靶RNA会引发附带的核酸裂解,降解RNA、单链DNA和双链DNA。这种活性导致细胞停滞,可能是通过破坏细胞中的DNA和RNA,从而损害生长。Cas12a2可用于分子诊断和RNA生物标记物的直接检测,这已得到原理证明。
Jackson和Hallmark是正在破译CRISPR-Cas系统的基本结构,以及是什么让它们运作的全球研究人员中的一员。Jackson说,“我们在这两篇论文中报道的研究结果几乎是在六年内完成的。”
在过去五年中被确认为一种独特的免疫系统,CRISPR-Cas12a2在某种程度上类似于更知名的CRISPR-Cas9,后者与目靶DNA结合并像分子剪刀一样切割它,从而有效地关闭靶基因。但是CRISPR-Cas12a2与CRISPR-Cas9结合的靶标不同,而且这种结合具有非常不同的效果。
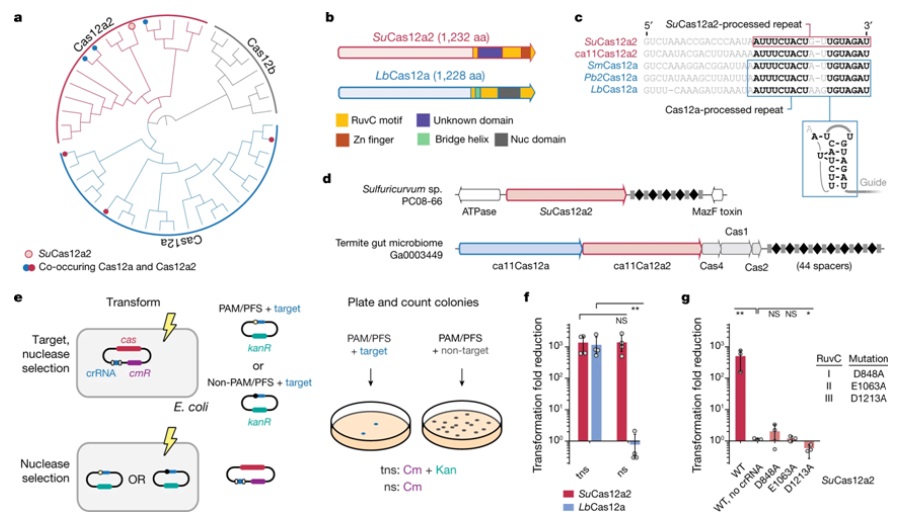
图为 Cas12a2核酸酶在V型Cas12核酸酶中形成了一个独特的分支
Jackson说,“Cas12a2蛋白在与RNA结合时发生了重大的构象变化,为DNA的破坏打开了一个不加区分的活性位点。Cas12a2破坏了靶细胞中的DNA和RNA,导致它们衰老。”
通过使用低温电镜(cryo-electron microscopy, cryo-EM),这些作者展示了CRISPR-Cas12a2的这一独特方面,包括它的RNA触发的单链RNA、单链DNA和双链DNA的降解,从而导致一种自然发生的防御策略,即顿挫性感染(abortive infection,也译为流产性感染)。
Hallmark说,“顿挫性感染是细菌和古生菌用来限制病毒和其他病原体传播的一种天然噬菌体抵抗策略。比如,顿挫性感染可以阻止已感染了宿主细胞的病毒成分进行复制。”
Jackson说,该团队在Cas12a2切割双链DNA的过程中捕捉到了它的结构。他说,“令人难以置信的是,Cas12a2核酸酶将通常笔直的一段双螺旋DNA弯曲了90度,以迫使这段双螺旋DNA的骨架进入这种核酸酶的活性位点,并在那里遭受切割。这是一种结构上的变化,观察起来很不寻常---这种现象引起了科学家同行的惊呼。”
在进一步结构分析中,他们发现Cas12a在免疫反应的不同阶段与它的靶RNA结合后会发生重大结构变化。这反过来又导致核酸酶出现一个暴露的裂缝,可以粉碎它遇到的任何核酸--无论是RNA、单链DNA还是双链DNA。他们还发现了一种让Cas12a2发生突变以改变它在识别它的RNA靶标后降解的核酸的方法。这些具体细节为未来开辟了潜在的广泛技术应用。
Jackson说,健康细胞和恶性细胞或被感染的细胞之间存在遗传上的区别。他说,“如果可以利用Cas12a2在遗传水平上识别、靶向和摧毁细胞,那么它的潜在治疗应用意义重大。”
此外,这两篇论文中描述的CRISPR-Cas12a2的RNA诊断能力,可能推动阻止一些遗传性疾病影响的努力。
Jackson说,“我们只是触及表面,但我们相信CRISPR-Cas12a2可能导致改进其他CRISPR-Cas技术,这将大大有利于社会。”
在一项新的研究中,来自美国艾伦细胞科学研究所(Allen Institute for Cell Science)的研究人员通过处理数十万张高分辨率图像,对人类细胞的内部组织(internal organization)---一种迄今为止被证明非常难以定量确定的生物学概念---进行了统计。他们还捕捉到了关于细胞形状丰富变化的细节,即使是在相同条件下生长的基因完全一致的细胞。相关研究结果于2023年1月4日在线发表在Nature期刊上,论文标题为“Integrated intracellular organization and its variations in human iPS cells”。

论文通讯作者、艾伦细胞科学研究所副主任Susanne Rafelski博士说,“细胞的组织方式告诉我们一些关于它们的行为和身份的信息。当我们都试图了解细胞在健康和疾病中如何变化时,这个领域一直缺少的是处理这种细胞内部组织的严格方法。我们还没有挖掘出这种信息。”
Rafelski说,这项新的研究为生物学家们提供了一个路线图,以一种可测量的、定量的方式了解不同类型的细胞的内部组织。它还揭示了这些作者研究的称为人类诱导性多能干细胞(human induced pluripotent stem cell, iPS细胞)的细胞的一些关键组织原则。
了解细胞在健康条件下如何组织自己---以及“正常”状态下所包含的全部变化---可以帮助科学家们更好地了解疾病中的问题所在。这项新研究中的图像数据集、经过基因改造的干细胞和代码都是公开的,供科学界中的其他科学家使用。
加州大学旧金山分校生物化学与生物物理学教授、艾伦细胞科学研究所科学顾问委员会成员Wallace Marshall博士说,“使得细胞生物学看起来难以解决的部分原因是,每个细胞看起来都不一样,即使它们是同一类型的细胞。这项新的研究表明,这种长期困扰该领域的可变性实际上是研究细胞内部组成规则的一个机会。这种方法几乎可以推广到任何细胞,我期望其他许多人也能采用同样的方法。”
计算我们的细胞的梨形度(pear-ness)
在七年多前启动的一项研究中,这些作者首先构建了一组经过基因改造后在荧光显微镜下可以照亮不同的内部结构的干细胞。有了对25种结构进行了荧光标记的细胞系,他们随后捕获了20万多个不同细胞的高分辨率三维图像。
所有这些都是为了提出一个看似简单的问题:我们的细胞是如何组织其内部的?他们的研究结果发现,要找到答案真地很复杂。想象一下,你的办公室里有数百件不同的家具,所有这些家具都需要随时取用,而且许多家具需要自由移动或根据它们的任务进行相互作用。现在想象一下,你的办公室是一个被一层薄膜包裹着的液体囊,而这数百件家具中的许多件甚至是更小的液体袋。这是室内设计的噩梦。
这些作者想知道:所有这些微小的细胞结构彼此之间是如何排列的?“A结构”总是在同一个地方,还是随机的?
他们在比较两个不同细胞之间的相同结构时遇到了挑战。即使被研究的细胞在基因上是完全相同的,并在相同的实验室环境中培养,它们的形状也有很大的不同。他们意识到,如果一个细胞很短,呈斑点状,另一个细胞很长,呈梨形,就不可能比较两个不同细胞中A结构的位置。因此,他们在那些短粗的斑点和细长的梨上标注了数字。
利用计算分析,这些作者开发了他们所谓的“形状空间(shape space)”,客观地描述每个干细胞的外部形状。这种形状空间包括八个不同的形状变化维度,如高度、体积、伸长率,以及恰如其分描述的“梨形度”和“豆形度(bean-ness)”。然后,他们可以将苹果与苹果(或豆子与豆子)进行比较,观察所有类似形状的细胞内部的结构组织。
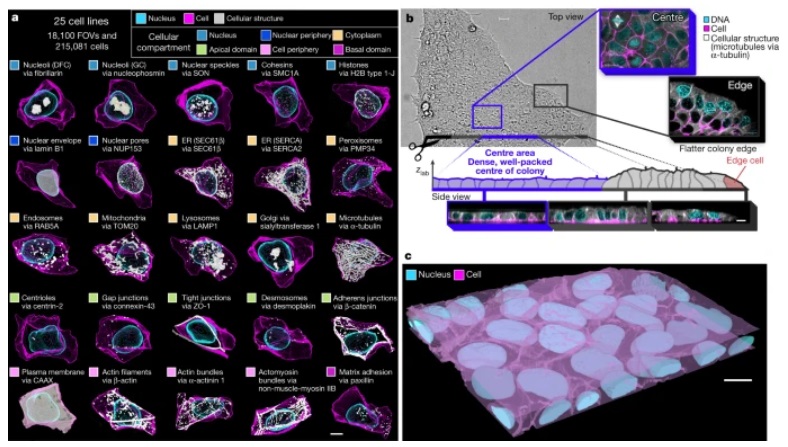
图为 WTC-11 hiPSC单细胞图像数据集v1包括25种代表位于细胞所有主要区室的关键细胞结构的细胞系
论文第一作者、艾伦细胞科学研究所的Matheus Viana博士说,“我们知道,在生物学中,形状和功能是相互关联的,了解细胞形状对了解细胞的功能很重要。我们提出了一个框架,使我们能够测量一个细胞的形状,在你这样做的那一刻,你可以找到形状相似的细胞,对于这些细胞,你就可以看里面的东西是如何排列的。”
严格的组织
当他们观察这25种经过荧光标记的结构的位置,比较一组具有类似形状的细胞中的这些结构时,他们发现所有的细胞都以非常相似的方式工作。尽管细胞形状存在巨大的差异,但它们的内部组织却惊人地一致。
如果你观察一下高层办公大楼里成千上万的白领如何摆放家具,就好像每个人都把办公桌放在办公室的正中央,而把文件柜正好放在最左边的角落,无论办公室的大小或形状如何。如果你发现一间办公室里的文件柜被扔在地上,文件散落一地---这可能会告诉你关于那间特定办公室和它的使用者的一些情况。
细胞的情况也是如此。发现偏离正常状态的情况可能为科学家们提供重要信息,了解细胞从静止状态过渡到移动状态、准备分裂时的变化,或者了解在疾病中微观层面出现的问题。这些作者观察了他们的数据集中的两种变化--处于细胞集落边缘的细胞,以及正在进行分裂以产生新子细胞的细胞,这一过程被称为有丝分裂。在这两种状态下,他们能够找到与细胞的不同环境或活动相关的内部组织变化。
艾伦细胞科学研究所执行主任Ruwanthi N. Gunawardane博士说,“这项研究汇集了我们在艾伦细胞科学研究所成立以来所做的一切。我们从头开始建立所有这些,包括测量和比较细胞组织方式的不同方面的指标。我真正感到兴奋的是,我们和科学界中的其他人如今可以在此基础上,提出我们以前无法提出的关于细胞生物学的问题。”
在一项新的研究中,研究人员构建出一个包含在人类细胞中发现的300多种蛋白激酶的综合图谱,并确定了它们可能靶向和控制哪些蛋白。相关研究结果于2023年1月11日在线发表在Nature期刊上。
人类最重要的酶之一是蛋白激酶,它们是调节几乎所有细胞活动(包括生长、细胞分裂和代谢)的信号分子。这些细胞途径的功能失调可导致多种疾病,特别是癌症。
识别参与细胞功能障碍和癌症发展的蛋白激酶可以产生许多新的药物靶标,但是对于这些激酶中的绝大多数,科学家们并没有清楚地了解它们参与了哪些细胞途径,或者它们的底物是什么。
美国麻省理工学院精准癌症医学中心主任Michael Yaffe教授说,“我们有大量的癌症基因组测序数据,但我们缺少的是对癌症中信号通路和蛋白激酶激活状态的大规模研究。如果我们有这些信息,我们就会对如何治疗特定的肿瘤有更好的想法。”

在一项新的研究中,Yaffe、耶鲁大学医学院的Benjamin E. Turk博士和威尔康乃尔医学院的Lewis C. Cantley博士及其同事们构建出一个包含在人类细胞中发现的300多种蛋白激酶的综合图谱,并确定了它们可能靶向和控制哪些蛋白。这些信息可能帮助科学家们破译许多细胞信号通路,并帮助他们发现当细胞发送癌变或用特定药物治疗时,这些信号通路会发生什么变化。相关研究结果于2023年1月11日在线发表在Nature期刊上,论文标题为“An atlas of substrate specificities for the human serine/threonine kinome”。
可靠线索
人类基因组包括500多种蛋白激酶,它们通过给其他蛋白标记上称为磷酸基团的化学修饰来激活或失活这些蛋白。对于这些激酶中的大多数,它们所靶向的蛋白是未知的,尽管对MEK和RAF等激酶的研究已导致了抑制这些激酶的新癌症药物,其中MEK和RAF这两种激酶都参与了控制生长的细胞途径。
为了确定癌细胞中失调的其他途径,这些作者依靠使用质谱的磷酸化蛋白质组学(phosphoproteomics)来发现癌细胞或健康细胞中磷酸化程度较高的蛋白。然而,在此之前,还没有一种简单的方法来研究质谱数据,以确定哪些蛋白激酶负责磷酸化这些蛋白。正因为如此,这些蛋白在疾病中是如何受到调控或遭受异常调控的仍是未知的。
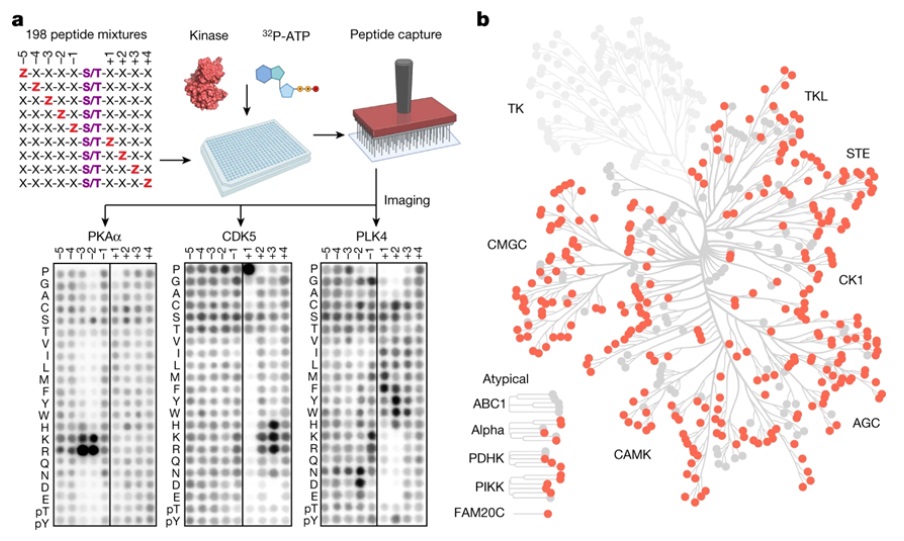
图为 分析人类丝氨酸/苏氨酸激酶组的底物特异性
Yaffe说,“对于大多数被测量的磷酸肽(phosphopeptide),我们不知道它们在信号传导途径中的位置。我们没有有效线索用来观察这些磷酸肽,然后说,这是这些数据告诉我们的信号传导途径。原因是对于大多数蛋白激酶,我们不知道它们的底物是什么。”
在这项新的研究中,这些作者分析了两类激酶---丝氨酸激酶和苏氨酸激酶,这两类激酶构成了人体中大约85%的蛋白激酶。他们利用Cantley和Turk之前创建的一个肽库来寻找与激酶相互作用的基序,随后测量了这些肽与所有303种已知的丝氨酸激酶和苏氨酸激酶的相互作用。对于这两类激酶而言,通过使用一种计算模型来分析他们观察到的相互作用,他们能够识别出能够使人类细胞中已报道的9万个已知磷酸化位点中的每一个磷酸化的激酶。
令他们吃惊的是,这些作者发现许多具有非常不同的氨基酸序列的激酶已经进化到能够结合和磷酸化其底物上的相同基序。他们还发现,他们所研究的激酶中约有一半靶向三大类基序之一,而剩下的一半则靶向大约十几个小类基序之一。
解码网络
Yaffe说,这种新的激酶图谱可以帮助科学家们识别正常细胞和癌细胞之间,或经过治疗的癌细胞和未经治疗的癌细胞之间不同的信号通路。他说,“这个激酶基序图谱现在可以让我们解读信号传导网络。我们可以看看所有这些磷酸化的肽,我们可以把它们对应到一种特定的激酶上。”
为了展示这种方法,这些作者分析了用一种抗癌药物处理的细胞,这种药物抑制一种叫做Plk1的激酶,该激酶调节细胞分裂。当他们分析磷酸化蛋白的表达时,他们发现许多受影响的蛋白是由Plk1控制的,正如他们预期的那样。令他们吃惊的是,他们还发现这种处理增加了两种激酶的活性,这两种激酶参与了细胞对DNA损伤的反应。
Yaffe实验室如今有兴趣使用这种图谱来尝试寻找其他驱动癌症发展的功能失调的信号通路,特别是在某些没有发现遗传驱动因素的癌症类型中。
他说,“我们如今可以用磷蛋白组学说,也许在这个病人的肿瘤中,这些途径是上调的,或者这些途径是下调的。我们现在可以利用磷酸化蛋白质组学来判断,也许在这名患者的肿瘤中,这些通路上调或下调。它可能会确定在由不明显的遗传因素导致癌症的情况下驱动癌症的信号通路。”
文章转载自生物谷,系出于传递更多信息之目的,转载内容不代表本站立场。如有侵权请及时联系,我们将立即进行删除处理。





 京公网安备 11011402010692号
京公网安备 11011402010692号




