RNA是以DNA的一条链为模板,以碱基互补配对原则,转录而形成的一条单链,主要功能是实现遗传信息在蛋白质上的表达,是遗传信息传递过程中的桥梁。mRNA是基因(DNA)转录后的产物,有基因(DNA)不一定能转录,相同的基因在不同的状况下转录得到mRNA的量也不一样。所以检测mRNA,可以在一定程度上反应该基因的表达情况。
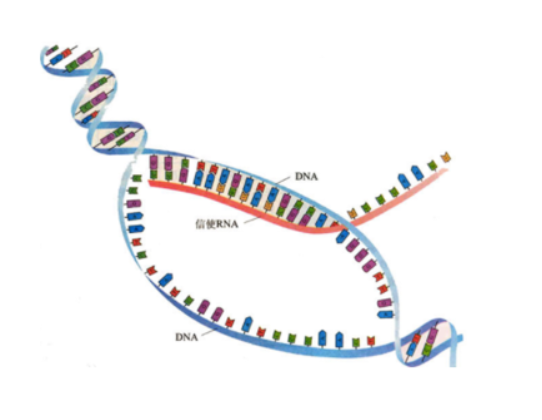
RNA的提取便是我们研究基因表达和调控的第一步,也是非常关键的一步。得到高质量的RNA对于后续很多实验的结果十分重要,例如RT-qPCR、实时荧光定量PCR、northernblot等。目前最常用的RNA提取方法是Trizol法,Trizol 试剂是由苯酚和异硫氰酸胍配制而成的快速抽提总RNA的试剂。在匀浆和裂解样品的过程中,Trizol 试剂能够保持RNA的完整性,同时能破碎细胞、降解细胞其它成分。在氯仿抽提、离心分离后,RNA处于水相中,将水相转管后用异丙醇沉淀RNA。将组织在液氮中磨碎,每50-100mg组织加入1ml TRIzol,用匀浆仪进行匀浆处理。样品体积不应超过TRIzol体积10%。如果是培养细胞,则直接在培养皿中加入TRIzol裂解细胞,每10cm2面积(即3.5cm直径的培养板)加1ml,用移液器吸打几次。将样品在室温(15-30℃)放置5分钟,使核酸-蛋白复合物完全分离。1 ml Trizol加入200ul预冷的氯仿,上下振荡15s,室温孵育5min。4℃,12000 g,离心15 min。分离得到三层,下层红色的酚-氯仿相、中间相以及上层无色水相,RNA存在于水相。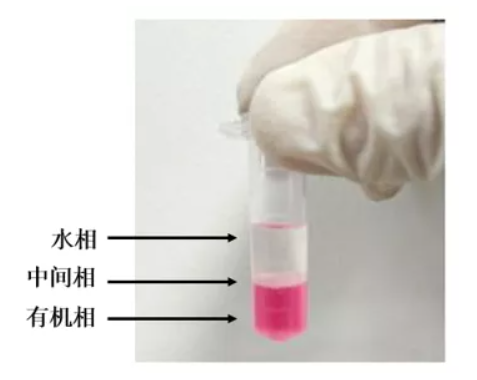
转移约400~500ul水相至新的离心管,加入等体积预冷的异丙醇,上下轻慢的混匀,室温静置10分钟后,4℃,12000g离心10min,弃上清。加入1ml预冷的75%乙醇,轻轻将整块沉淀吹起悬浮, 4℃,7500 g,离心5 min。此时,试管底部可见少量白色沉淀,尽量吸尽上清,室温干燥3-5min,待沉淀周围无明显残留液体时,视沉淀大小加入30-50ul RNase free水,充分溶解沉淀,保存于-80℃。以无RNase水作空白对照,测OD260/280值。1 OD=40μg RNA。OD260/280值在1.8-2.0视为纯度很高。一般浓度在1000ng/ml较准。浓度太高要稀释以后再测定。甲醛变性琼脂糖电泳,确定抽提RNA完整性和DNA污染情况。若RNA质量较好,可见18S和28S两条明显的RNA条带,且28S条带亮度更高,最理想的是28S亮度为18S的2倍。
1.最好使用新鲜组织,或者-80℃(液氮)保存半年内的组织,避免RNA降解影响RNA提取的效果。2.提取过程尽量在冰上操作,低温离心,防止在操作过程中RNA降解。3.所用器材均需经过DEPC浸泡,高压灭菌后才能使用,所有试剂均需保证无RNA酶污染。4.在吸取水相时需注意少吸、轻吸,不能吸到中间相,避免中间相中的蛋白和基因组DNA造成污染和RNA降解。
返回列表





