我们如何学会新技能?大脑如何编码新信息?这些问题的答案指向了大脑的突触可塑性——神经元之间连接强度的变化。然而,长期以来,科学家们对大脑在学习过程中如何选择特定突触进行可塑性改变的规则知之甚少。
如今,加州大学圣地亚哥分校的研究团队在《Science》杂志上发表了一项突破性研究,揭示了个中奥秘。

研究团队利用先进的双光子成像技术,对小鼠运动皮层中的突触活动进行了实时观测。他们发现,在学习过程中,神经元的不同树突区域遵循着截然不同的突触可塑性规则。具体来说,顶树突的可塑性是由局部突触的协同活动驱动的,而基底树突的可塑性则与神经元的动作电位活动密切相关。这种差异表明,单个神经元在学习过程中同时运用了多种可塑性规则,且这些规则在神经元的不同区域发挥作用。
“这一发现从根本上改变了我们对大脑如何解决‘学分分配问题’的理解。”研究通讯作者Takaki Komiyama教授说道,“我们过去认为突触可塑性在整个大脑内遵循统一的规则,但这项研究表明,单个神经元在不同的亚细胞区域并行执行不同的计算任务。”
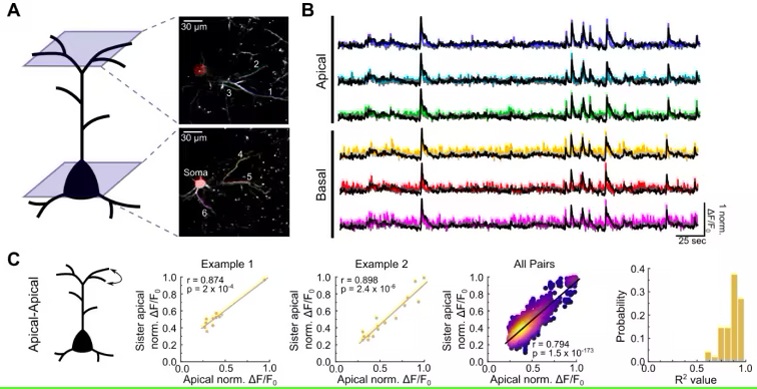
实验结果显示,在学习过程中,顶树突的突触可塑性主要受到局部突触的协同活动的影响。具体来说,那些在学习初期表现出较高协同活动的顶树突突触,在后续的训练中更有可能发生长期增强(LTP)。相比之下,基底树突的突触可塑性则更多地依赖于神经元的动作电位活动。研究团队发现,阻断神经元的动作电位活动会显著影响基底树突的LTP,而对顶树突的可塑性影响较小。
这些发现为理解大脑如何在学习过程中选择特定突触进行可塑性改变提供了新的视角。研究团队还观察到,顶树突中的突触在学习过程中倾向于形成功能性的簇,这可能有助于神经元整合多种信息流。
这些新发现不仅增进了我们对大脑学习机制的理解,还为人工智能的发展提供了新的思路。传统的人工神经网络通常遵循一套统一的学习规则,而这项研究表明,大脑中的突触可塑性规则是多样化的。这一发现可能促使科学家们设计出更加高效的类脑神经网络,以提高人工智能系统的性能。
此外,这项研究还为治疗多种神经疾病提供了潜在的新方法。许多神经疾病,包括成瘾、创伤后应激障碍、阿尔茨海默病和自闭症等,都与突触功能障碍有关。通过深入理解突触可塑性的规则,科学家们有望开发出针对这些疾病的新型治疗方法。
“这项研究为理解大脑的正常工作方式奠定了潜在的基础,使我们能够更好地了解这些不同疾病的发病原因。”研究第一作者William Wright表示。
综上,这项研究不仅为神经科学领域带来了新的洞见,也为人工智能和医学领域的发展提供了新的方向。随着科学家们对大脑学习机制的深入理解,我们有望迎来更加智能的人工系统和更加有效的治疗方法,为人类健康和福祉做出贡献。

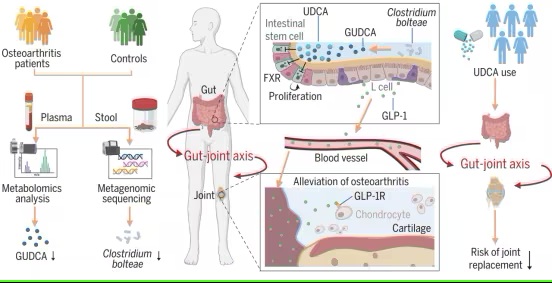
肠道菌群-GUDCA-肠道FXR–GLP-1关节通路为骨关节炎提供了潜在的治疗方法

Engleman说,“这是我们对癌症免疫系统如何开启和关闭的理解的一个根本性突破。我对这一发现感到非常兴奋,我希望靶向我们发现的这一机制的治疗方法能够迅速进入人体试验。”
可能适用于多种癌症
尽管这项研究是在小鼠身上完成的,但有强有力的迹象表明,这种称为促红细胞生成素(erythropoietin, EPO)在许多类型的人类癌症中起着类似的作用。
此外,研究人员观察到,分配给某个记忆痕迹的神经元重组了某些细胞内结构,这些结构提供能量并支持神经元连接中的交流和可塑性。这些神经元还与称为星形胶质细胞的支持细胞增强了相互作用。
Engleman说,“十多年前的研究表明,给患有贫血的癌症患者服用EPO以刺激红细胞形成,可以加速肿瘤的生长。”
这种联系是如此惊人,以至于2007年美国食品药品管理局(FDA)要求在药物EPO上贴上黑色的警告标签,警告癌症患者不要使用。科学家们还发现,患者预后与肿瘤中天然存在的EPO及其受体(EPOR)水平之间存在明显的相关性。
Engleman说,“之前的研究清楚地表明,肿瘤中的EPO或EPOR越多,患者的情况就越差。但EPO与癌症免疫之间的联系直到现在才建立起来。事实上,我们花了很长时间和大量实验才相信EPO在阻断癌症免疫反应方面发挥着至关重要的作用,因为EPO作为一种红细胞生长因子已经得到了很好的证实。”
Chiu开发并研究了基因组编辑技术,创建了几种癌症小鼠模型,以研究肝脏肿瘤如何发展和对治疗的反应。每种模型重现了人类肝癌亚型中发现的特定突变、组织学特性和对已批准的疗法的反应。通过将一组与肝癌相关的DNA编码蛋白注射到小鼠的尾静脉中或通过将肝癌细胞植入小鼠的肝脏中来诱导肿瘤形成。
Engleman及其团队对一种常见的免疫疗法对癌症生长的影响感兴趣,其中该免疫疗法靶向T细胞表面上的PD-1分子。与PD-1的结合阻断了癌细胞抑制T细胞活性的能力。抗PD-1免疫疗法,包括商业上销售的派姆单抗(Keytruda)药物,通常用于治疗多种类型的人类癌症,包括黑色素瘤、霍奇金淋巴瘤和某些类型的肺癌。在某些情况下,它们改变了患者的预后。但绝大多数肿瘤,包括大多数肝癌、胰腺癌、结肠癌、乳腺癌和前列腺癌,都对这类治疗有抵抗力。
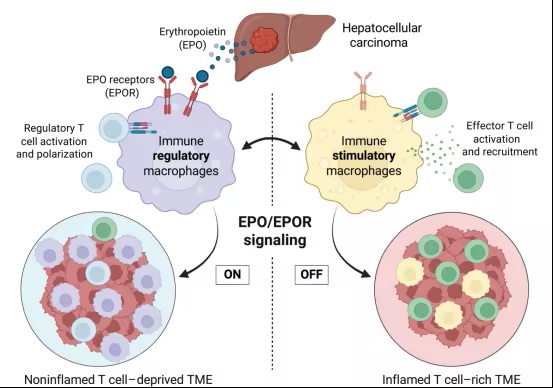
Engleman团队发现,与在人类肝癌中观察到的情况类似,一些突变组合导致了在很大程度上被免疫系统忽视的肝脏肿瘤的发展,使其具有免疫特权,或者说变成冷肿瘤。当用抗PD-1疗法治疗这些小鼠时,这些肿瘤没有缩小,因为肿瘤中存在很少的T细胞。与冷肿瘤相反,其他突变导致充满T细胞的热肿瘤。这些肿瘤对抗PD1疗法高度敏感,从而触发T细胞攻击癌症。
出乎意料的是,与热肿瘤相比,冷肿瘤显示出EPO水平升高。这种增加可能是由冷肿瘤中普遍存在的缺氧微环境引起的。缺氧诱导癌细胞产生蛋白质,从而增加EPO的产生,以便产生更多的红细胞来对抗低氧水平。
Engleman说,“几十年来,人们一直在研究肿瘤中的缺氧。包括我在内的任何人都没有意识到,EPO在这种情况下除了作为红细胞生长因子外,还可以做任何事情。”
出于好奇,Engleman团队借助于现有的数据库,证实EPO水平升高与肝癌、肾癌、乳腺癌、结肠癌和皮肤癌患者的生存率较低有关。然后,他们修补了肿瘤细胞制造EPO的能力,并对小鼠肝脏肿瘤中发生的事情感到惊讶。他们发现,当这些肿瘤经修饰后无法产生EPO时,导致冷肿瘤发展的突变反而会导致热肿瘤产生。相反,以前被免疫系统成功根除的热肿瘤在经过基因工程改造后产生更高水平的EPO时茁壮成长。
进一步的详尽研究表明,在冷肿瘤中,这些肿瘤细胞制造并分泌EPO,EPO与巨噬细胞表面上的受体(EPOR)结合。然后,这些巨噬细胞转变为免疫抑制作用,赶走杀伤癌症的T细胞并抑制其活性。
当Engleman团队研究同时阻断EPO信号传导通路和抗PD-1通路的组合效应时,这种EPO调节的肿瘤细胞和巨噬细胞之间的沟通的重要性得到了明确的体现。在实验中,携带冷肝脏肿瘤的小鼠无论是接受抗PD-1治疗还是接受对照治疗在诱导肿瘤形成后,均未存活超过8周。相比之下,当实验终止时,巨噬细胞无法制造EPOR的小鼠中的40%在肿瘤诱导后存活了18周。当对缺乏EPOR的小鼠进行抗PD-1治疗时,它们在实验期间都存活了下来。
Engleman说,“这很简单。如果你通过降低EPO水平或阻断巨噬细胞表面上的EPO受体(EPOR)来消除这种EPO信号传导,那么你不仅会减少肿瘤生长,还会使肿瘤消退,并对抗PD-1治疗产生敏感性。”
Engleman和他的同事们如今正在设计靶向人类癌症中EPO信号传导的治疗方法。非特异性靶向EPO蛋白可能导致贫血,Engleman推测这对于一种有效的癌症治疗来说可能是一种可接受的权衡。另一种方法是选择性阻断癌症中巨噬细胞表面上的EPO受体(EPOR)。
Engleman说,“我仍然对这一发现感到惊讶。并不是每个肿瘤都会有同样的反应,但我非常乐观,这一发现将带来强大的新癌症疗法。”
针对这一发现,Chiu和Engleman提交一篇标题为“EPO受体激动剂和拮抗剂”的PCT专利申请(PCT/US2023/063997)。





 京公网安备 11011402010692号
京公网安备 11011402010692号




